
【题目】2.3 g纯净金属钠在干燥空气中被氧化后得到3.5 g固体,由此可判断出产物是
A. Na2O B. Na2O2
C. Na2O和Na2O2的混合物 D. 无法确定
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】一个由锌片和石墨棒作为电极的原电池如图所示,电极反应分别是:
锌片:2Zn﹣4e﹣+4OH﹣═2ZnO+2H2O 石墨:2H2O+O2+4e﹣═4OH﹣
下列说法中不正确的是( )

A.电子从石墨经外电路流向锌片,电解质溶液为酸性溶液
B.锌片是负极,石墨是正极
C.电池总反应为2Zn+O2═2ZnO
D.该原电池工作一段时间后石墨附近溶液中的c(OH﹣)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝热反应可用于焊接钢轨,反应为:2Al + Fe2O3 ![]() 2Fe + Al2O3,下列关于该反应说法正确的是
2Fe + Al2O3,下列关于该反应说法正确的是
A. Al 是还原剂 B. Fe2O3 发生氧化反应
C. Fe 是氧化产物 D. 当生成 1 mol Fe 时,转移 6 mol 电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了防止食品受潮及富脂食品氧化变质,在包装袋中应放入的独立包装的物质是
A. 无水硫酸铜、蔗糖 B. 食盐、硫酸亚铁
C. 生石灰、还原铁粉 D. 生石灰、食盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上运用电化学方法降解含NO3-废水的原理如图所示,下列有关说法不正确的是

A. 相同条件下,Pt电极上产生O2和Pt-A电极上产生N2的体积比为5:2
B. 通电时电子的流向:b电极→导线→Pt-Ag电极→溶液→Pt电极→导线→a极
C. Pt-Ag电极上的电极反应式:2NO3-+12H++10e-=N2+6H2O
D. 通电时,Pt电极附近溶液的pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素X、Y、Z和W在周期表中的位置如图所示,原子序数之和为48。下列说法不正确的是
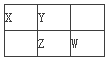
A. 原子半径(r)大小比较r(X)>r(Y)
B. X和W可形成化合物XW3
C. W的非金属性比Z的强,所以W氢化物的沸点比Z的高
D. Z的最低价单核阴离子的失电子能力比Y的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是
A. 常温常压下,124 g P4中所含P—P键数目为4NA
B. 100 mL 1mol·L1FeCl3溶液中所含Fe3+的数目为0.1NA
C. 标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2NA
D. 密闭容器中,2 mol SO2和1 mol O2催化反应后分子总数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅及其化合物在工业生产、生活中具有非常广泛的用途。
(1)瓦纽科夫法熔炼铅,其相关反应的热化学方程式如下:
①2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) △H1=akJ·mol-1
②PbS(s)2PbO(s)=3Pb(s)+SO2(g) △H2=b kJ·mol-1
③PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) △H3=c kJ·mol-1
反应3PbS(s)+6O2(g)=3PbSO4(s) △H=____________kJ·mol-1(用含a、b、c的代数式表示)
(2)以含铅废料(主要含Pb、PbO、PbO2、PbSO4)为原料制备高纯PbO,其主要流程如下:
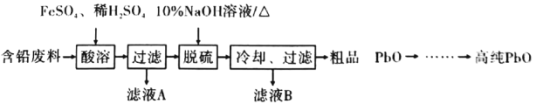
①“酸溶”时,在Fe2+催化下,Pb和PbO2反应成1 mol PbSO4时转移电子的物质的量为_________ mol。
②已知:PbO溶解在NaOH溶液中,存在化学平衡:PbO(s)+NaOH(aq)![]() NaHPbO2(aq),其溶解度曲线如图1所示:
NaHPbO2(aq),其溶解度曲线如图1所示:

结合上述信息,完成由粗品PbO(所含杂质不溶于NaOH溶液)得到高纯PbO的操作:将粗品PbO溶解在一定量________(填“35%”或“10%”)的NaOH溶液中,加热至110℃,充分溶解后,_______________(填 “趁热过滤”或“蒸发浓缩”),将滤液冷却结晶,过滤、洗涤并干燥得到高纯PbO固体。
(3)将粗品PbO溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液生成Pb的装置如图2所示:

①阴极的电极反应式为______________________;
②当有4.14gPb生成时,通过质子交换膜的n(H+)=______________________。
(4)PbI2可用于人工降雨。取一定量的PbI2固体,用蒸馏水配制成t℃饱和溶液,准确移取25.00 mL PbI2饱和溶液分次加入阳离子交换树脂RH+(发生反应:2RH++PbI2 =R2Pb+2H++2I-),用250ml洁净的锥形瓶接收流出液,后用蒸馏水淋洗树脂至流出液呈中性,将洗涤液一并盛放到锥形瓶中(如图3)。加入酚酞指示剂,用0.0050mol·L-1NaOH溶液滴定,当达到滴定终点时,用去氢氧化钠溶液10.00mL。可计算出t℃时Ksp(PbI2)为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是原子序数依次增大的四种短周期主族元素。其中X、Y为金属元素,W和Z同主族。Z的核外电子数是W的2倍,W和Z的质子数之和等于X和Y的质子数之和。下列说法不一定正确的是()
A. 原子半径:![]()
B. 工业冶炼Y的方法是电解熔融Y的氧化物
C. W和X组成的化合物为碱性氧化物
D. 向W、X、Y组成的化合物水溶液中滴入稀盐酸至过量,溶液先变浑浊后澄清
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com