
��14�֣�����������SnSO4����һ����Ҫ��������ˮ�������Σ��㷺Ӧ���ڶ�����ҵ��ij�о�С�����SnSO4�Ʊ�·�����£�

�������ϣ�
I�����������£�����ˮ��Һ����Sn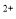 ��Sn
��Sn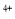 ������Ҫ������ʽ��Sn
������Ҫ������ʽ��Sn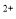 �ױ�������
�ױ�������
��SnCl2��ˮ�����ɼ�ʽ�Ȼ�������Sn(OH)C1�ݡ�
�ش��������⣺
��1������1�IJ���Ϊ �� �����ˡ�ϴ�ӡ�����Գ�������ϴ�ӵķ����� ��
��2��SnCl2��ĩ���Ũ��������ܽ⣬���ϱ�Ҫ�Ļ�ѧ����ʽ����ѧ��Ӧԭ������ԭ�� ��
��3������Sn�۵��������������ٵ�����ҺpH���� ��
��4��SnSO4��������������������˫��ˮ��ȥ������������Ӧ�����ӷ���ʽ�ǣ� ��
��5����С��ͨ�����з����ⶨ�������۵Ĵ��ȣ����ʲ����뷴Ӧ����ȡ����Ϊm����������ϡ�����У������ɵ�SnSO4�м��������Fe2(SO4)3��Һ�������ʵ���Ũ��Ϊc��K2Cr2O7����Һ�ζ����ɵ�Fe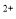 ����֪���Ի�����Cr2O
����֪���Ի�����Cr2O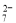 �ɱ���ԭΪCr
�ɱ���ԭΪCr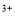 ��������ȥK2Cr2O7��Һ�����ΪV������������������������ ����Sn��Ħ������ΪM���ú�m��c��V��M�Ĵ���ʽ��ʾ��
��������ȥK2Cr2O7��Һ�����ΪV������������������������ ����Sn��Ħ������ΪM���ú�m��c��V��M�Ĵ���ʽ��ʾ��
��14�֣���1������Ũ����1�֣�����ȴ�ᾧ��1�֣����ز�����������ˮע��©���У�ֱ����û��
��2��SnCl2ˮ�⣬����SnCl2+H2O Sn��OH��Cl+HCl���������ᣬʹ��ƽ�������ƶ�������Sn2+ˮ�� ��3����ֹSn2+������ ��4��Sn2++H2O2+2H+��Sn4++2H2O ��5��
Sn��OH��Cl+HCl���������ᣬʹ��ƽ�������ƶ�������Sn2+ˮ�� ��3����ֹSn2+������ ��4��Sn2++H2O2+2H+��Sn4++2H2O ��5��
��������
�����������1��������ͼ��֪���������Ǵ���Һ�еõ����ᾧˮ�ľ��壬ֻ�ܲ�ȡ����Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ�����õ���������ϴ���ڹ���������ɣ����ز�����������ˮע��©���У�ֱ����û������ˮ�������ظ�����2��3�Σ�
��2������Ϣ��֪��SnCl2��ˮ�����ɼ�ʽ�Ȼ�����������ƽ��Sn Cl2+H2O Sn��OH��Cl+HCl���������ᣬʹ��ƽ�������ƶ�������Sn2+ˮ�⣻
Sn��OH��Cl+HCl���������ᣬʹ��ƽ�������ƶ�������Sn2+ˮ�⣻
��3������Ϣ��֪��Sn2+�ױ�����������Sn�۳�������ҺpH�⣬����ֹSn2+��������
��4�����������£�SnSO4����������˫��ˮȥ������˫��ˮ��ǿ�����ԣ���Sn2+�ױ�����ΪSn4+����������ԭΪˮ�����ӷ���ʽΪ��Sn2++H2O2+2H+��Sn4++2H2O��
��5����������������������Ϊx����
Sn��Sn2+��2Fe3+��2Fe2+��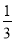 K2Cr2O7����
K2Cr2O7����
M 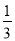
mx cV
��
���x��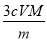
���㣺��SnSO4�Ʊ�Ϊ���忼��Թ������̵����⡢���ʵķ����ᴿ���Ķ���Ŀ��ȡ��Ϣ�����������û�ѧ������д���ζ�Ӧ�ü����ù�ϵʽ���еļ���


 ʱ�����������ҵԭ���ܳ�����ϵ�д�
ʱ�����������ҵԭ���ܳ�����ϵ�д� ����νӽ̲���ĩ���Ԥϰ�人������ϵ�д�
����νӽ̲���ĩ���Ԥϰ�人������ϵ�д� ������ҵ��ٳɳ����½������������ϵ�д�
������ҵ��ٳɳ����½������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015�����ĸ����꼶�ڶ����¿����ۻ�ѧ�Ծ��������棩 ���ͣ������
��14�֣�
��ͼ�У�A��B��C��D��E�ǵ��ʣ�G��H��I��F��B��C��D��E�ֱ��A�γɵĶ�Ԫ�������֪��
��ӦC��G B��H�ܷų��������ȣ�G�Ǻ���ɫ�����ĩ��
B��H�ܷų��������ȣ�G�Ǻ���ɫ�����ĩ��
��I��һ�ֳ������������壬����E���Է�����Ӧ��2E��I 2F��D��F�е�EԪ�ص���������Ϊ60%��
2F��D��F�е�EԪ�ص���������Ϊ60%��
�ش����⣺
��1�����з�Ӧ�Ļ�ѧ����ʽΪ____________________________________
��2�� 1.6g G �������ᣬ�õ�����Һ��ͭ����ȫ��Ӧ��������Ҫͭ��_______��
��3�� C�����NaOH��Һ��Ӧ�����ӷ���ʽΪ________________________����Ӧ�����Һ������Ļ�����I��Ӧ�����ӷ���ʽΪ________________________________
��4�� E��I��Ӧ�Ļ�ѧ����ʽΪ__________________________________
��5�� д��H�����ڹ�ҵ�ϵ�һ����;_____________��
��6����һ������B��ȫ���ڹ��������У�Ȼ��ͨ��0.005mol Cl2���ټ���0.01mol�ظ���ؾ���(K2Cr2O7����ǡ��ʹ��Һ��B2+ȫ��ת��ΪB3+����Ԫ�ر�������ԭΪ+3�۸����ӡ�ͨ������ȷ��ԭB�����ʵ���Ϊ�� ��
A��0.01mol B��0.03mol C��0.04mol D��0.07mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����һ�и�����ѧ9�¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵����ȷ���ǣ���
A��ͬ�����ͬ�ܶȵ�C2H4��C3H6����ԭ����һ�����
B��ͬ����Ԫ�ص�������۶���ͬ
C��CH3COONa��NaOH�л�ѧ��������ȫ��ͬ
D�� �������5�����ӵ�ԭ�Ӷ��Ƿǽ���ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ2015�����9�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵����ȷ����
A������ˮ���γɵ�Al��OH��3����������ˮ�������������ˮ�ľ���
B��ͨ��ʱ����Һ�е��������ӷֱ��������ƶ��������еķ�ɢ��������ijһ���ƶ�
C����Һ���������ӵ��˶��й��ɣ������з�ɢ�����ӵ��˶�����,���������˶�
D�����MgCl2������Һ�����Ƶý���þ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ�������������ۿ��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���ֶ�����Ԫ�ص�ijЩ�������±���ʾ:
Ԫ�ش��� | X | W | Y | Z | Q |
ԭ�Ӱ뾶����10-12 m�� | 37 | 99 | 66 | 104 | 154 |
��Ҫ���ϼ� | +1 | -1��+7 | -2 | -2��+6 | +1 |
����˵����ȷ���ǣ� ��
A����Q��Y�γɵĻ�������ֻ�������Ӽ�
B��Z��X֮���γɵĻ�������л�ԭ��
C��X��YԪ����ɵĻ�����ķе����X��ZԪ����ɻ�����ķе�������Y�ǽ����Ա�Zǿ
D��Y��Q��W����Ԫ����ɻ������ˮ��Һһ���Լ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ�����и���һ�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪��������Һ�еĻ�ԭ��ǿ��˳��Ϊ��SO2 > I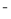 > H2O2 > Fe
> H2O2 > Fe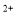 > Cl
> Cl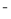 �����з�Ӧ�����ܷ�������
�����з�Ӧ�����ܷ�������
A��2I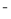 + Fe
+ Fe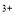 =I2 + Fe
=I2 + Fe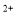
B��2Fe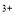 + SO2 + 2H2O=2Fe
+ SO2 + 2H2O=2Fe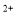 + SO
+ SO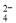 + 4H+
+ 4H+
C��SO2 + 2H2O + I2=H2SO4 + 2HI
D��H2O2 + H2SO4=SO2�� + O2�� + 2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ�����и�����һ�ģ�⿼�����ۻ�ѧ�Ծ��������棩 ���ͣ������
(15��)ijͬѧ����������ƺϳɿ�������I�߷��ӻ�����G·�����£�
��֪����A�����к���3���� ��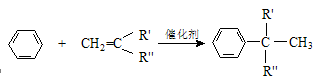
��ش��������⣺
��1��C�ķ���ʽΪ �� A������Ϊ ��
��2����Ӧ�ٵķ�Ӧ����Ϊ ��G�Ľṹ��ʽΪ
��3��д��D������Cu(OH)2��Һ��Ӧ�Ļ�ѧ����ʽ��
��4��������Ӧ������ȡ����Ӧ���� ������ţ�
��5��F���ڶ���ͬ���칹�壬д��������������������ͬ���칹��
���ܷ���ˮ�ⷴӦ������ʹ������Ȼ�̼��Һ��ɫ �ں˴Ź���������ʾ��3����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ�����и�����ѧ�ڵڶ����¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪��H2(g��+  O2(g) �T H2O(g) ��H1=��241.8kJ?mol��1��C(s)+
O2(g) �T H2O(g) ��H1=��241.8kJ?mol��1��C(s)+  O2(g) �T CO(g) ��H2=��110.5kJ?mol��1���ɴ˿�֪��̿��ˮ������Ӧ���Ȼ�ѧ����ʽΪ��C(s)+H2O(g) �T CO(g)+H2(g) ��H3�����H3Ϊ
O2(g) �T CO(g) ��H2=��110.5kJ?mol��1���ɴ˿�֪��̿��ˮ������Ӧ���Ȼ�ѧ����ʽΪ��C(s)+H2O(g) �T CO(g)+H2(g) ��H3�����H3Ϊ
A��+131.3 kJ?mol��1
B����131.3 kJ?mol��1
C��+352.3 kJ?mol��1
D����352.3 kJ?mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ�ɶ�����������11��ͳһ��⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
NA���������ӵ�����������������ȷ����
A��0.1 mol��ϩ���к���˫������ĿΪ0.1NA
B�����³�ѹ�£�Cu��Znԭ����У���������1.12 L H2ʱ��ת�Ƶĵ�����ӦΪ0.1NA
C��һ�������¶��������г���3molH2��g����1 mol N2��g��������Ӧ��H2��g��+ N2��g�� 2NH3 ��g������H= ��QkJ/mol�����÷�Ӧ�ų�0.25QkJ������ʱ�������е������������2.25 NA
2NH3 ��g������H= ��QkJ/mol�����÷�Ӧ�ų�0.25QkJ������ʱ�������е������������2.25 NA
D����50 g��������Ϊ46%���Ҵ�ˮ��Һ�У����е���ԭ������Ϊ3NA
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com