
下列化学实验事实的描述及其结论都正确的是
| A.将饱和氯水滴到淀粉碘化钾试纸上,试纸先变蓝后变白,说明氯水具有漂白性 |
| B.将SO2通入含HClO的溶液中,生成H2SO4,说明HClO酸性比H2SO4强 |
| C.FeCl3溶液可以腐蚀印刷电路板上的Cu,说明Fe的金属活动性大于Cu |
| D.铝箔在酒精灯火焰上加热熔化但不滴落,说明铝箔表面氧化铝熔点高于铝 |
D
解析试题分析:饱和氯水中Cl2先与KI发生置换反应,淀粉遇置换出的I2变蓝,然后过量饱和氯水中的Cl2与I2发生氧化还原反应,生成HIO3和HCl,I2被消耗导致试纸变白,上述反应中氯元素由0降为—1价,说明氯气是氧化剂,或者氯水具有强氧化性,而非漂白性,故A错误;二氧化硫被次氯酸氧化为硫酸,说明次氯酸的氧化性比硫酸强,该反应是氧化还原反应,而非复分解反应,因此不能说明次氯酸的酸性比硫酸强,故B错误;氯化铁溶液能腐蚀铜,说明铜的还原性比亚铁离子的强,铁离子氧化性比铜离子的强,该反应不是置换反应,不能说明铁和铜的金属活动性,故C错误;铝表面总是覆盖着保护膜,构成保护膜的氧化铝的熔点高于铝的熔点,包在铝的外面,所以熔化的液态铝不会滴下来,故D正确。
考点:考查元素化合物的主要性质,涉及氯水的强氧化性、碘离子和碘单质的还原性、淀粉的显色反应、二氧化硫的还原性、次氯酸的强氧化性和弱酸性、硫酸的强酸性、铁离子和铜离子的氧化性、铜和亚铁离子的还原性、铝和氧化铝的熔点等。


科目:高中化学 来源: 题型:单选题
下列各组物质充分反应后,只能得到一种气体的是
| A.木炭和浓硫酸共热 |
| B.Na2O2与足量的稀硫酸反应 |
| C.足量的铜跟一定量的浓硝酸反应 |
| D.汽油在汽车发动机中燃烧后排出的气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关物质的性质与应用均正确的是
| A.常温下Cl2能与强碱溶液反应,工业生产和实验室可用澄清石灰水吸收氯气尾气 |
| B.苯酚遇FeCl3溶液显紫色,可用FeCl3溶液检验工业生产的废水中是否存在苯酚 |
| C.铜的金属活动性比铁的弱,可在海轮外壳上装若干铜块以减缓船体的腐蚀速率 |
| D.碳酸钠溶液与硫酸钙能发生复分解反应,可用硫酸钠溶液清除锅炉水垢中的碳酸钙 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列陈述I、II正确并且有因果关系的是
| 选项 | 陈述I | 陈述II |
| A | Br2蒸气和NO2都是红棕色气体 | 可用淀粉碘化钾水溶液鉴别 |
| B | BaSO4和BaCO3都是难溶物 | 医疗上都能用作“钡餐” |
| C | 硬铝是合金 | 其熔点比金属铝的熔点低 |
| D | 电镀时阴极上发生还原反应 | 可在铁的镀件上镀铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列陈述I、II正确且有因果关系的是
| 选项 | 陈述I | 陈述II |
| A | SO2有漂白性 | SO2可使酸性高锰酸钾溶液褪色 |
| B | 硫酸铜是强酸弱碱盐 | 蒸干CuSO4溶液可以得到Cu(OH)2固体 |
| C | SO2是酸性氧化物 | 将SO2通入BaCl2溶液可生成BaSO3沉淀 |
| D | 氢氧化铝显两性 | 向AlCl3溶液中滴加氨水,产生白色沉淀;再加入过量NaOH溶液,沉淀消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是
| A.SiO2可溶于强碱溶液,不溶于任何酸 |
| B.当光束通过淀粉溶液时,无法观察到丁达尔现象 |
| C.铝热反应可用于焊接钢轨和金属的冶炼 |
| D.漂白粉的有效成分是有强氧化性的氯化钙和次氯酸钙 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列实验操作及现象能够达到对应实验目的的是
| 选项 | 实验操作及现象 | 实验目的 |
| A | 将SO2通入品红溶液中,品红溶液褪色;加热褪色后的品红溶液,溶液恢复红色 | 验证亚硫酸的不稳定性 |
| B | 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有少量气泡产生 | 证明常温下 Ksp(BaCO3)>Ksp(BaSO4) |
| C | 常温下,测定物质的量浓度相同的盐酸和醋酸溶液的pH:盐酸pH小于醋酸pH | 证明相同条件下,在水溶液中HCl电离程度大于CH3COOH |
| D | 将浓硫酸与碳混合加热,直接将生成的气体通入足量的石灰水,石灰水变浑浊 | 检验气体产物中CO2的存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列化学实验事实及其结论都正确的是( )
| 选项 | 实验事实 | 结论 |
| A | 将SO2通入含HClO的溶液中生成H2SO4 | HClO的酸性比H2SO4强 |
| B | 铝箔在酒精灯火焰上加热熔化但不滴落 | 铝箔表面氧化铝熔点高于铝 |
| C | SiO2可以和NaOH溶液及HF溶液反应 | SiO2属于两性氧化物 |
| D | 将SO2通入溴水中,溴水褪色 | SO2具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上利用软锰矿(主要成分为MnO2,同时含少量铁、铝等的化合物)制备硫酸锰的常见流程如下: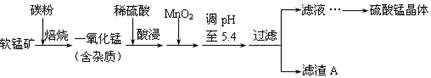
部分金属阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 10.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com