
分析 (1)配制一定量物质的量浓度溶液时,容量瓶的规格要等于或略大于配制溶液体积;
(2)弱电解质部分电离,反应速率与氢离子浓度成正比,pH相等的强酸和弱酸稀释相同的倍数后,弱酸中氢离子浓度大于强酸.
解答 解:(1)配制一定量物质的量浓度溶液时,容量瓶的规格要等于或略大于配制溶液体积,实验室有100mL的容量瓶,所以选取100mL的容量瓶,故答案为:100 mL容量瓶;
(2)pH相等的强弱酸中,加水稀释促进弱酸电离,导致稀释后弱酸中氢离子浓度大于强酸,氢离子浓度越大,反应速率越大,所以如果装HA溶液的试管中放出H2的速率快就证明HA为弱酸,故选b.
点评 本题考查弱电解质的判断,为高频考点,明确强弱电解质的根本区别是解本题关键,注意:不同酸与相同金属反应时与氢离子浓度成正比,与酸的强弱无关,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 加入甲基橙显红色的溶液中:Mg2+、Fe2+、Cl-、NO3- | |
| B. | pH=12的无色透明溶液中:Mg2+、SO42-、NO3-、K+ | |
| C. | 无色透明溶液中:SO42-、NO3-、Na+、Fe3+ | |
| D. | 澄清透明溶液中:Cu2+、SO42-、K+、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
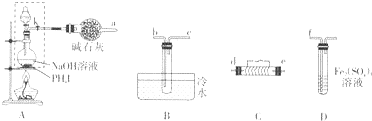
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
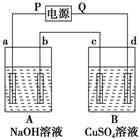 按图中装置实验,A、B两烧杯分别盛放200g 10% NaOH溶液和足量CuSO4溶液.通电一段时间后,c极上有Cu析出,又测得电路通过电子0.5mol,试回答:
按图中装置实验,A、B两烧杯分别盛放200g 10% NaOH溶液和足量CuSO4溶液.通电一段时间后,c极上有Cu析出,又测得电路通过电子0.5mol,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用于合成氨的工业煤气中含有H2S、C2H5SH(乙硫醇)、COS(羰基硫)、CS2等含硫化合物,工业上无机硫常用氧化锌法处理,有机硫可用钴钼催化加氢处理.
用于合成氨的工业煤气中含有H2S、C2H5SH(乙硫醇)、COS(羰基硫)、CS2等含硫化合物,工业上无机硫常用氧化锌法处理,有机硫可用钴钼催化加氢处理.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 石蕊试液 | 品红溶液 | 饱和硫化氢溶液 | 氯水 | |
| A | 无色 | 无色 | 乳白色浑浊 | 无色 |
| B | 红色 | 无色 | 黄色浑浊 | 无色 |
| C | 红色 | 无色 | 乳白色浑浊 | 黄绿色 |
| D | 无色 | 无色 | 乳白色浑浊 | 黄绿色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用CCl4可擦去圆珠笔油渍 | |
| B. | 蚊虫叮咬处涂抹肥皂水可止痛痒 | |
| C. | 煮鱼时加入少量食醋和料酒可除腥味,增加香味 | |
| D. | 小苏打可用作焙制面包 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将适量的发酵粉放在容器中加热,观察气体的产生 | |
| B. | 在洁净的水杯中先加入小苏打粉,再加入食醋,观察气体 | |
| C. | 往稀白粥中加入少量加碘食盐,检验加碘食盐中含有I2 | |
| D. | 在一瓣橘子上插入两根铜丝并与小灯泡连接,验证电流的产生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com