
【题目】CH3OH是一种重要的化工原料。工业上常以CO和H2的混合气体为原料制备甲醇,其反应方程式为CO+2H2CH3OH。
(1)一定条件下向2 L的密闭容器中通入一定量的CO和H2使其发生上述反应,n(CO)随时间的变化如下表所示:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
n(CO)/mol | 1.0 | 0.8 | 0.5 | 0.25 | 0.20 | 0.20 |
①平均反应速率最大的时间段:___________min(填 “0~1”、“1~2” 、“2~3”“3~4”或“4~5”)。
②从反应开始到3 min末,氢气的平均反应速率v(H2)=______________mol·L-1·min-1
③能够判断该反应达到平衡的是________(填字母) 。
a.v逆(CO)=2v正(H2)
b.CO、H2和CH3OH三种物质的浓度相等
c.CH3OH分解的速率和CH3OH生成的速率相等
d.相同时间内消耗1molCO,同时消耗1molCH3OH
④工业上用CO和H2为原料制备甲醇的过程中,会有副产物二甲醚(CH3OCH3)生成,写出该反应的化学方程式:__________.
(2)甲醇燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、氧气、KOH溶液构成,电池总反应为2CH3OH+3O2+4OH-=2![]() + 6H2O,其装置图下图所示。
+ 6H2O,其装置图下图所示。
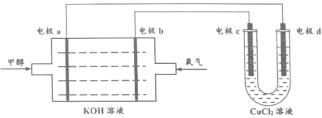
①电极a为电池的_______(填 “正极”或“负极”)
②电极b的电极反应式:________。
③电极C的电极反应式:________。
【答案】1~2 0.25 cd 2CO+4H2→CH3OCH3+H2O 负极 O2+4e-+2H2O=4OH- 2Cl--2e-=Cl2
【解析】
(1)①由不同时间段CO物质的量的变化量多少进行判断;
②先计算出CO的平均反应速率,再根据速率之比等于化学计量数之比计算出H2的平均反应速率;
③可逆反应达到平衡状态的判断标志是原来变化的量不变了,据此分析判断;
④由甲醇与二甲醚的分子式之间的关系进行分析;
(2)甲醇燃料电池中,甲醇在负极发生氧化反应,氧气在正极发生还原反应,据此分析解答。
(1)①在5min内的几个时间段内,CO物质的量的减少量分别为:0.2mol、0.3mol、0.25mol、0.05mol、0mol,从而可以确定平均反应速率最大的时间段为CO物质的量的减少量最多的时间段,即1~2min,答案为:1~2;
②由表中数据可知,从反应开始到3 min末,CO物质的量的减少量为1.0mol-0.25mol=0.75mol,则v(CO)=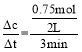 =0.125 mol·L-1·min-1,根据速率之比等于化学计量数之比,反应CO+2H2CH3OH中氢气的平均反应速率v(H2)=2v(CO)=2×0.125 mol·L-1·min-1=0.25 mol·L-1·min-1,答案为:0.25;
=0.125 mol·L-1·min-1,根据速率之比等于化学计量数之比,反应CO+2H2CH3OH中氢气的平均反应速率v(H2)=2v(CO)=2×0.125 mol·L-1·min-1=0.25 mol·L-1·min-1,答案为:0.25;
③反应为CO+2H2CH3OH
a. 根据反应可得出v正(H2)=2 v正(CO),故v逆(CO)=2v正(H2)时反应没有达到平衡,a不符题意;
b. CO、H2和CH3OH三种物质的浓度相等,反应可能处于平衡状态,也可能未处于平衡状态,这与反应开始时加入的反应物的多少及反应的转化率等有关,b不符题意;
c.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等,即正逆反应速率相等,可以判断反应达到平衡,c符合题意;
d. 对于反应CO+2H2CH3OH,相同时间内消耗1molCO,同时消耗1molCH3OH说明正逆反应速率相等,可以判断反应达到平衡,d符合题意,答案选cd;
④1mol的二甲醚(CH3OCH3)可以看作是2mol的甲醇(CH3OH)发生分子间脱水生成,由CO+2H2CH3OH可以推出用CO和H2生成副产物二甲醚的反应为:2CO+4H2→CH3OCH3+H2O,答案为:2CO+4H2→CH3OCH3+H2O;
(2)甲醇燃料电池甲醇在负极失去电子发生氧化反应,氧气在正极得到电子发生还原反应
①由图可知电极a处通入甲醇,故电极a为负极,答案为:负极;
②由图可知电极b处通入氧气,电极b为正极,氧气在正极得到电子发生还原反应,碱性条件下氧气发生的反应为:O2+4e-+2H2O=4OH-,答案为:O2+4e-+2H2O=4OH-;
③由图可知电极c与燃料电池的正极相连,所以电极c为电解池的阳极,电极c为惰性电极,电解质溶液为CuCl2溶液,所以在电极c上发生反应的是溶液里的阴离子,由于放电顺序Cl->OH-,故电极c的电极反应式为:2Cl--2e-=Cl2,答案为:2Cl--2e-=Cl2。


科目:高中化学 来源: 题型:
【题目】研究表明,通过碘循环系统可以吸收工业废气中的SO2制备一种重要的化工原料M,同时完成氢能源再生(如图所示)。下列说法错误的是( )
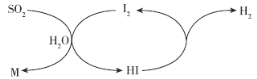
A.开发氢能源有利于社会可持续发展
B.为提高SO2的吸收效率,应不断分离出HI
C.I2为整个循环过程的催化剂
D.M为硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
化合物F(异戊巴比妥)是临床常用的镇静催眠药物,其合成路线如下(部分反应条件和试剂略):
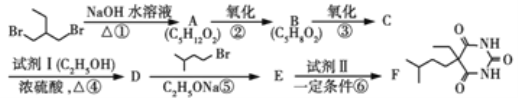
已知:
(1)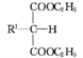 +R2Br+C2H5ONa
+R2Br+C2H5ONa![]()
 +C2H5OH+NaBr(R1,R2代表烷基)
+C2H5OH+NaBr(R1,R2代表烷基)
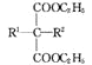
(2)R—COOC2H5+![]()
![]()
![]() (其他产物略)
(其他产物略)
请回答下列问题:
(1)试剂Ⅰ的化学名称是____,化合物B的官能团名称是______,第④步的化学反应类型是____。
(2)第①步反应的化学方程式是____________________。
(3)第⑤步反应的化学方程式是_____________________。
(4)试剂Ⅱ的相对分子质量为60,其结构简式是 ___________________。
(5)化合物B的一种同分异构体G与NaOH溶液共热反应,生成乙醇和化合物H。H在一定条件下发生聚合反应得到高吸水性树脂,该聚合物的结构简式是_________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于自然界中氮循环(如图)的说法不正确的是:
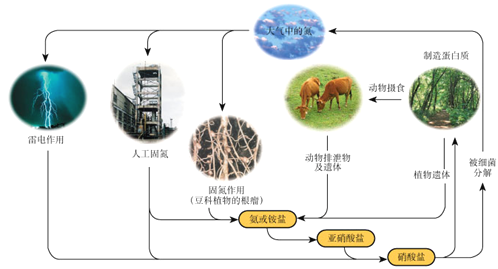
A. 氮元素均被氧化
B. 工业合成氨属于人工固氮
C. 含氮无机物和含氮有机物可相互转化
D. 碳、氢、氧三种元素也参与了氮循环
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室验证钠能与二氧化碳发生反应,并确定其产物的装置如图所示,(已知:PdC12溶液遇CO能产生黑色的Pd),下列说法错误的是( )
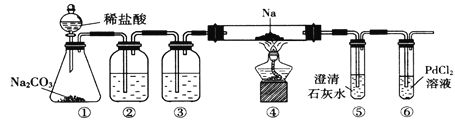
A. 装置①的仪器还可以制取H2气体
B. 装置⑤中石灰水变浑浊后,再点燃酒精灯
C. 装置②③中分别盛装饱和Na2CO3溶液、浓H2SO4
D. 装置⑥中有黑色沉淀,发生的反应是PdC12+CO+H2O=Pd↓+CO2+2HC1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,向20mLcmol·L-1KOH溶液中滴加0.1mol·L-1HCOOH溶液,混合溶液中水电离的氢氧根离子浓度与滴加甲酸(弱酸)溶液体积(V)的关系如图所示。下列说法正确的是
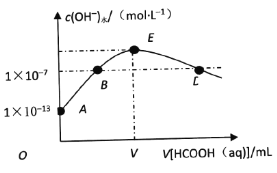
A. 上述KOH溶液的浓度c=0.01mol·L-1
B. B点对应的溶液中:c(K+)=c(HCOO-)
C. E点对应的溶液中:c(OH-)>c(H+)=c(HCOOH)
D. 若D点对应的甲酸溶液体积为V1mL,则HCOOH电离平衡常数![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 常温、常压下,4.6 g NO2和N2O4混合气体中含有的氧原子数目为0.2NA
B. 1 mol的羟基与1 mol的氢氧根离子所含电子数均为10NA
C. 将0.1 mol FeCl3溶于1 L水中,所得溶液含Fe3+离子数目为0.1NA
D. 在高温下,1 mol Fe与足量的水蒸气反应,转移电子的数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式及有关应用的叙述中,不正确的是
A.在同温同压下,热化学方程式2H2(g)+O2(g)==2H2O(l)ΔH1;2H2(g)+O2(g)==2H2O(g)ΔH2,反应热ΔH1ΔH2
B.已知强酸与强碱在稀溶液里反应的中和热为57.3kJmol-1,则![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)═
Ba(OH)2(aq)═![]() BaSO4(s)+H2O(l)△H-57.3kJmol-1
BaSO4(s)+H2O(l)△H-57.3kJmol-1
C.500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,则:N2(g)+3H2(g)![]() 2NH3(g)△H-38.6kJmol-1
2NH3(g)△H-38.6kJmol-1
D.甲烷的燃烧热为890.3kJmol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+![]() O2(g)═CO(g)+2H2O(l)△H=-890.3kJmol-1
O2(g)═CO(g)+2H2O(l)△H=-890.3kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. pH=7的溶液:K+、Na+、Cl-、Fe3+
B. 能使酚酞显红色的溶液:Na+、Mg2+、HCO3-、SO42-
C. c(H+)/c(OH-)=1012的溶液:K+、Fe3+、Cl-、SO42-
D. 水电离出的c(H+)=10-13 mol·L-1的溶液:Ca2+、NH4+、NO3-、HCO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com