
| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红棕色液体 |
| 密度/g•cm-3 | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
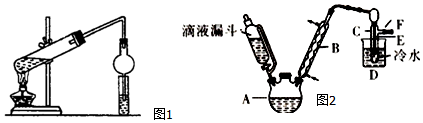
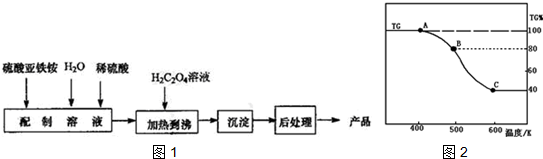
分析 Ⅰ.在大试管中先注入乙醇,再分别缓缓加入浓硫酸、乙酸(乙醇和浓硫酸的加入顺序不可互换),乙醇和乙酸在浓硫酸催化作用下生成乙酸乙酯,发生反应方程式为CH3COOH+C2H5OH  CH3COOC2H5+H2O,小试管中饱和碳酸钠溶液除去乙酸、吸收乙醇、降低乙酸乙酯的溶解度,则球形干燥管可防止液体倒吸,以此来解答;
CH3COOC2H5+H2O,小试管中饱和碳酸钠溶液除去乙酸、吸收乙醇、降低乙酸乙酯的溶解度,则球形干燥管可防止液体倒吸,以此来解答;
II.(3)加热时加快反应速率蒸出溴乙烷;
(4)根据溴乙烷和溴的性质,逐一分析能够和溴反应且不能和溴乙烷反应试剂,注意除杂不能引进新的杂质.
解答 解:(1)装置中干燥管的作用是防止小试管中液体发生倒吸,故答案为:防止小试管中液体发生倒吸;
(2)浓硫酸溶于水放出大量的热,乙醇中含有少量水,应将浓硫酸加入到乙醇中,防止硫酸溶解时放出大量的热导致液体飞溅,则加入药品的顺序为先在大试管中注入乙醇,再分别缓缓加入浓硫酸和乙酸(乙酸和浓硫酸的加入顺序可互换),边加边振荡试管使之混合均匀,即加入顺序为乙醇、浓硫酸、乙酸,
故答案为:B;
(3)加热的目的是加快反应速率,温度高于38.4°C溴乙烷全部挥发蒸馏出来,但是为了控制温度,应采取水浴加热,
故答案为:水浴加热;
(4)A.氢氧化钠,加氢氧化钠会引起溴乙烷水解,故A错误;
B.加亚硫酸钠只与溴反应不与溴乙烷反应,故B正确;
C.除去溴乙烷中的少量杂质Br2,加碘化钠会引入碘单质杂质,故C错误;
故选B.
点评 本题考查有机物的制备实验,为高频考点,把握制备实验原理、物质的性质、实验技能等为解答的关键,侧重分析与实验能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 达到化学平衡时,5v正(O2)=4v逆(NO) | |
| B. | 若单位时间内生成x mol NO,同时消耗x mol NH3,则可确定反应达到平衡状态 | |
| C. | 达到化学平衡时,若增大容器的体积,则正反应速率减小,逆反应速率也减小 | |
| D. | 化学反应速率的关系是2v正(NH3)=3v正(H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 防止废旧电池重金属盐对土壤水资源造成污染,大力开发废旧电池综合利用技术 | |
| B. | 为减少北方雾霾,作物秸秆禁止直接野外燃烧,研究开发通过化学反应转化为乙醇用作汽车燃料 | |
| C. | 为节约垃圾处理的费用,大量采用垃圾的填埋 | |
| D. | 为减少温室气体排放,应减少燃煤.大力发展新能源,如核能、风能、太阳能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com