
| A. | 0.1 mol铁在0.1 mol Cl2中充分燃烧,转移的电子数为0.2 NA | |
| B. | 标准状况下,5.6L水中含有的分子数为0.25NA | |
| C. | 20g D2O中含有的质子数目为10NA | |
| D. | 标准状况下,22.4 LCO2和O2混合气体中含有的氧原子数为2NA |
分析 A、0.1mol铁和0.1mol氯气反应时,铁过量;
B、标况下水为液态;
C、求出重水的物质的量,然后根据重水中含10个质子来分析;
D、求出混合气体的物质的量,然后根据二氧化碳和氧气中含有2个氧原子来分析.
解答 解:A、0.1mol铁和0.1mol氯气反应时,铁过量,故0.1mol氯气完全反应,反应后变为-1价,故0.1mol氯气转移0.2NA个电子,故A正确;
B、标况下水为液态,故不能根据气体摩尔体积来计算其物质的量,故B错误;
C、20g重水的物质的量为1mol,而重水中含10个质子,故1mol重水中含10NA个质子,故C正确;
D、标况下22.4L混合气体的物质的量为1mol,而二氧化碳和氧气中含有2个氧原子,故1mol混合物中含2NA个氧原子,故D正确.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 具有规则几何外形的固体均为晶体 | |
| B. | 晶体具有自范性,非晶体没有自范性 | |
| C. | 没有固定熔点 | |
| D. | 将玻璃加工成规则的固体即变成晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 8.5 | B. | 17 | C. | 16 | D. | 34 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同条件下,2 mol SO2(g)和1 mol O2(g)所具有的能量小于2 mol SO3(g)所具有的能量 | |
| B. | 2 mol SO2(g)和1 mol O2(g)在密闭容器中充分反应,放出热量小于Q kJ | |
| C. | 增大压强或升高温度,该反应过程都能放出更多的热量 | |
| D. | 2 mol SO2(g)和1 mol O2(g)在密闭容器中充分反应,放出热量等于Q kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| T | M层上电子数是K层上电子数的3倍 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
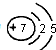 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
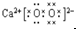 :和水反应的方程式为2CaO2+2H2O═2Ca(OH)2+O2↑;
:和水反应的方程式为2CaO2+2H2O═2Ca(OH)2+O2↑;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,4g H2含有的分子数为 2NA | |
| B. | 8g H2O在标准状况下的体积是22.4L | |
| C. | 2.3g金属钠变为钠离子时失去的电子数为NA | |
| D. | 17g氨气所含电子数目为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
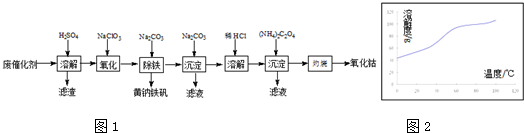
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制盐酸溶液,用量筒取盐酸时俯视刻度线 | |
| B. | 配制盐酸溶液定容时,仰视容量瓶 | |
| C. | 称量4gNaOH配制0.20mol/L NaOH溶液500mL时,砝码错放左盘 | |
| D. | 配制NaOH溶液时,溶液未经冷却即注入容量瓶并定容至刻度线 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com