
| A. | 配制盐酸溶液,用量筒取盐酸时俯视刻度线 | |
| B. | 配制盐酸溶液定容时,仰视容量瓶 | |
| C. | 称量4gNaOH配制0.20mol/L NaOH溶液500mL时,砝码错放左盘 | |
| D. | 配制NaOH溶液时,溶液未经冷却即注入容量瓶并定容至刻度线 |
分析 结合c=$\frac{n}{V}$及不当操作对n、V的影响判断浓度的变化,以此来解答.
解答 解:A.配制盐酸溶液,用量筒取盐酸时俯视刻度线,n(HCl)偏小,由c=$\frac{n}{V}$可知,c偏低,故A不选;
B.配制盐酸溶液定容时,仰视容量瓶,水加多,则V偏大,由c=$\frac{n}{V}$可知,c偏低,故B不选;
C.称量4gNaOH配制0.20mol/L NaOH溶液500mL时,砝码错放左盘,m(NaOH)偏小,n(NaOH)偏小,由c=$\frac{n}{V}$可知,c偏低,故C不选;
D.溶液未经冷却即注入容量瓶并定容至刻度线,则V偏小,由c=$\frac{n}{V}$可知,c偏高,故D选;
故选D.
点评 本题考查一定物质的量浓度溶液的配制,为高频考点,把握浓度、物质的量、体积的关系为解答的关键,侧重分析与实验能力的考查,注意不当操作对n、V的影响,题目难度不大.


 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol铁在0.1 mol Cl2中充分燃烧,转移的电子数为0.2 NA | |
| B. | 标准状况下,5.6L水中含有的分子数为0.25NA | |
| C. | 20g D2O中含有的质子数目为10NA | |
| D. | 标准状况下,22.4 LCO2和O2混合气体中含有的氧原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
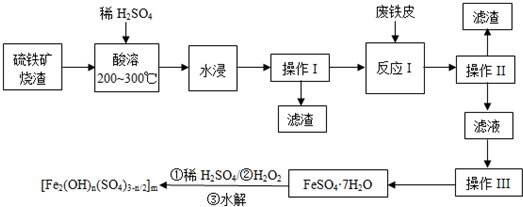
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3是碱 | B. | NaHCO3是酸 | C. | NaHCO3是盐 | D. | NaHCO3是一元酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子最外层电子数的周期性变化 | |
| B. | 原子半径呈现从大到小的周期性变化 | |
| C. | 元素化合价呈现周期性的变化 | |
| D. | 元素的金属性和非金属性呈现周期性的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题.
研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钡溶液和盐酸 | B. | 硝酸银溶液和硝酸 | ||
| C. | 氯化钡溶液和硝酸银溶液 | D. | 硝酸钡溶液和硝酸银溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
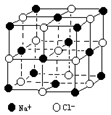 晶体具有规则的几何外形,晶体中最基本的重复单元称之为晶胞.NaCl晶体结构如图所示.
晶体具有规则的几何外形,晶体中最基本的重复单元称之为晶胞.NaCl晶体结构如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com