
元素的性质随着元素原子序数的递增而呈周期性变化的原因是
A.元素原子的核外电子排布呈周期性变化
B.元素的原子半径呈周期性变化 C.元素的化合价呈周期性变化
D.元素的金属性、非金属性呈周期性变化
科目:高中化学 来源: 题型:
航天飞船可用肼(N2H4)和过氧化氢(H2O2)为动力源。已知1 g液态肼和足量液态过氧化氢反应生成氮气和水蒸气时放出20.05 kJ的热量。下列说法中错误的是( )
A、该反应中肼作还原剂
B、液态肼的燃烧热为20.05 kJ·mol-1
C、该动力源的突出优点之一是生成物对环境污染小
D、肼和过氧化氢反应的热化学方程式为:
N2H4(l)+2H2O2(l)===N2(g)+4H2O(g) ΔH=-641.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
反应2SO2+O2  2SO3经一段时间后,SO3的浓度增加了0.4mol·L-1,在这段时间时间内用O2表示的平均反应速率为0.04mol·L-1·s-1,则这段时间为
2SO3经一段时间后,SO3的浓度增加了0.4mol·L-1,在这段时间时间内用O2表示的平均反应速率为0.04mol·L-1·s-1,则这段时间为
A.0.1s B.2.5s C.5s D.10s
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.汽油、柴油和植物油都是碳氢化合物
B.淀粉和蛋白质均可作为生产葡萄糖的原料
C.石油裂化和油脂皂化都是高分子生成小分子的过程
D.装饰材料中的甲醛和芳香烃会造成居室污染
查看答案和解析>>
科目:高中化学 来源: 题型:
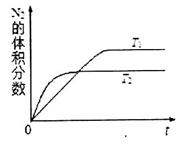 为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要。
为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要。
(1)汽车内燃机工作时会引起N2和O2的反应: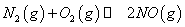 ,是导致汽车尾气中含有NO的原因之一。
,是导致汽车尾气中含有NO的原因之一。
①在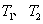 温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如右图所示,根据图像判断反应
温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如右图所示,根据图像判断反应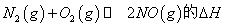 __________0(填“>”或“<”)。
__________0(填“>”或“<”)。
②在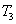 温度下,向2L密闭容器中充入10molN2与5mo1O2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率
温度下,向2L密闭容器中充入10molN2与5mo1O2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率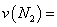 ___________________。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为____________。
___________________。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为____________。
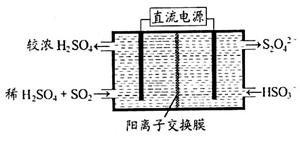 (2)利用右图所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2。
(2)利用右图所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2。
①阳极的电极反应式为_____________________。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有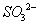 生成。该反应中氧化剂与还原剂的物质的量之比为_______________。
生成。该反应中氧化剂与还原剂的物质的量之比为_______________。
(3)一定条件下可用甲醇与CO反应生成醋酸消除CO污染。常温下,将a mol·L 的醋酸与b mol
的醋酸与b mol L
L
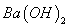 溶液等体积混合,充分反应后,溶液中存在
溶液等体积混合,充分反应后,溶液中存在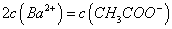 ,则该混合溶液中醋酸的电离常数Ka=______________________(用含a和b的代数式表示)。
,则该混合溶液中醋酸的电离常数Ka=______________________(用含a和b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,不属于取代反应的是
A.在催化剂存在条件下苯与溴反应制溴苯
B.苯与浓硝酸、浓硫酸混合共热制取硝基苯
C.乙烯与溴生成1,2二溴乙烷
D.在光照条件下甲烷和氯气反应制氯仿
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学反应速率的说法中,正确的是
A.往容积一定的容器中再通入O2,可以加快反应2SO2+O2 2SO3的反应速率
2SO3的反应速率
B.用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率
C.对于C(s)+H2O(g)  CO(g)+H2(g)的反应,加入固体炭,反应速率加快
CO(g)+H2(g)的反应,加入固体炭,反应速率加快
D.100 mL 2 mol·L-1的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.用湿润的pH试纸测溶液的pH
B.用蒸馏法可将海水淡化为可饮用水
C.常温下浓硫酸不能盛放在铝制容器中
D.配制溶液时仰视容量瓶刻度线定容会使溶液浓度偏高
查看答案和解析>>
科目:高中化学 来源: 题型:
某种兴奋剂的结构简式如图所示,下列说法正确的是 ( )

A.该分子中的所有碳原子一定在同一个平面上
B.滴入酸性KMnO4溶液,观察紫色褪去,能证明结构中存在碳碳双键
C.遇FeCl3溶液呈紫色,因为该物质与苯酚属于同系物
D.1mol该物质分别与浓溴水、H2反应,最多消耗Br2和H2的物质的量分别为4mol、7mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com