
| 实验编号 | HA物质的量浓度(mol•L-1) | NaOH物质的量浓度(mol•L-1) | 混合溶液的pH |
| 甲 | C | 0.2 | pH=7 |
| 乙 | 0.2 | 0.1 | pH=a |
| 丙 | 0.2 | 0.2 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
分析 (1)若HA为弱酸,与NaOH恰好反应生成NaA,NaA水解显碱性,溶液显中性,则HA过量;结合电荷守恒分析;
(2)HA与NaOH反应生成NaA、HA,溶液显碱性,说明A-水解大于HA的电离;
(3)等物质的量的酸碱反应后溶液呈碱性,由于NaOH为强碱,则该酸为弱酸;
(4)等物质的量的酸碱反应后溶液呈碱性,溶液中氢氧根离子全部来自于弱酸根离子水解得到的,水电离出的氢离子等于水电离出的氢氧根离子,根据电荷守恒计算.
解答 解:(1)若HA为弱酸,与NaOH恰好反应生成NaA,NaA水解显碱性,溶液显中性,则HA过量,所以C不一定等于0.2;中性溶液中存在电荷守恒为c(OH-)+c(A-)=c(Na+)+c(H+),因为c(OH-)=c(H+),所以c(A-)=c(Na+);
故答案为:否;c(A-)=c(Na+);
(2)0.2mol/L的HA与0.1mol/L的NaOH等体积反应生成NaA、HA,溶液的pH>7,则溶液显碱性,说明A-水解大于HA的电离,所以HA为弱酸;
故答案为:若a>7,混合液显碱性,溶液中A-水解大于HA的电离,则HA是弱酸;
(3)等物质的量的酸碱反应后溶液呈碱性,由于NaOH为强碱,则该酸为弱酸,在溶液中存在A-+H2O?HA+OH-,则c(Na+)>c(A-),溶液呈碱性,则c(OH-)>c(H+),一般来说,盐类的水解程度较低,则有c(A-)>c(OH-),所以有:c(Na+)>c(A-)>c(OH-)>c(H+),
故答案为:弱;c(Na+)>c(A-)>c(OH-)>c(H+);
(4)溶液的pH=9,则氢离子浓度为10-9 mol/L,等物质的量的酸碱反应后溶液呈碱性,溶液中氢氧根离子全部来自于弱酸根离子水解得到的,c(OH-)=$\frac{Kw}{c({H}^{+})}$=$\frac{1{0}^{-14}}{1{0}^{-9}}$mol/L=10-5 mol/L,水电离出的氢离子浓度等于溶液中氢氧根离子浓度为10-5 mol/L;
故答案为:10-5.
点评 本题考查酸碱混合溶液的定性判断及计算,把握盐类水解、酸碱混合的物质的量关系及pH计算等为解答的关键,侧重分析与计算能力的考查,题目难度中等.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:选择题
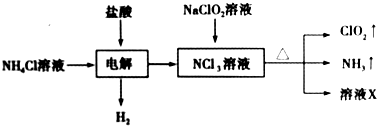
| A. | 电解时发生反应的离子方程式为NH4++3Cl-$\frac{\underline{\;电解\;}}{\;}$2H2↑+NCl3 | |
| B. | 溶液X中大量存在的阴离子有Cl-、OH- | |
| C. | 可用饱和食盐水除去ClO2中的NH3 | |
| D. | 可用明矾除去饮用水中残留的NaClO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第六周期第ⅢA族的元素Tl,其氢氧化物的碱性比Al(OH)3弱 | |
| B. | 卤族元素At的单质为有色固体,AgAt可能不溶于水也不溶于稀硝酸 | |
| C. | Li与水反应比钠与水反应剧烈 | |
| D. | H2Se是无色,有毒,比H2S稳定的气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+) | B. | c(CH3COO-) | ||
| C. | $\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$的比值 | D. | $\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$的比值 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铜使菌体蛋白质盐析 | |
| B. | 石灰乳使菌体蛋白质水解 | |
| C. | 铜离子在碱性条件下使菌体蛋白质变性 | |
| D. | 蛋白质可以溶解波尔多液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
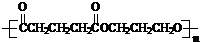 )是一种可降解的聚酯类高分子材料,在材料的生物相容性方面有很好的应用前景.PPG的一种合成路线如下:
)是一种可降解的聚酯类高分子材料,在材料的生物相容性方面有很好的应用前景.PPG的一种合成路线如下: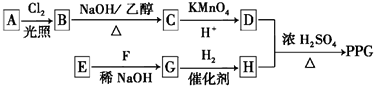
 .
.
 .
. .
. .
.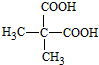 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有机物只能从有机体中取得 | |
| B. | 有机物和无机物的组成、结构、性质有严格区别,它们不能相互转化 | |
| C. | 人类只是从现代才使用有机物 | |
| D. | 合成树脂、合成橡胶、合成纤维等均属于有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
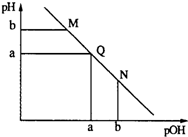
| A. | M点和N点溶液中H2O的电离程度相同 | |
| B. | Q点溶液中,c(NH4+)+c(OH-)=c(Cl-)+c(H+) | |
| C. | M点溶液的导电性大于Q点溶液的导电性 | |
| D. | N点溶液加水稀释,$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
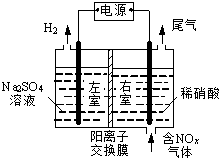 电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益.实验室模拟电解法吸收NOx的装置如右图所示(图中电极均为石墨电极).
电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益.实验室模拟电解法吸收NOx的装置如右图所示(图中电极均为石墨电极).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com