
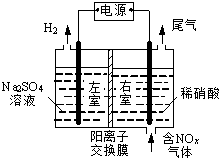
 电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益.实验室模拟电解法吸收NOx的装置如右图所示(图中电极均为石墨电极).
电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益.实验室模拟电解法吸收NOx的装置如右图所示(图中电极均为石墨电极).分析 (1)①根据图知,电解时,左室中电极上氢离子放电生成氢气,则左室为阴极室,右室为阳极室,阳极上通入的是氮氧化物,生成的硝酸,所以阳极上氮氧化物失电子和水生成硝酸;
②n(NO2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,阳极反应式为NO2-e-+H2O=NO3-+2H+,有0.2mol氢离子生成,因为有0.1mol硝酸生成,则有0.1mol氢离子引入阴极室;
(2)①浓硝酸的物质的量浓度=$\frac{1000ρω}{M}$=$\frac{1000×1.4×63%}{63}$mol/L=14mol/L,根据溶液稀释前后溶质的物质的量不变计算;
②n(H2)=$\frac{28L}{22.4L/mol}$=1.25mol,根据转移电子守恒得转移电子物质的量=1.25mol×2=2.5mol,
电解前溶液中n(HNO3)=0.2mol/L×10L=2mol,电解后溶液中含3mol HNO3、0.1molHNO2,说明电解过程中有1mol HNO3、0.1molHNO2生成,
根据N原子守恒得n(NO)+n(NO2)=3 mol-0.2 mol•L-1×10 L+0.1 mol=1.1 mol,
生成0.1mol亚硝酸转移电子0.1mol且需要0.1mol电子,则生成硝酸转移电子物质的量=2.5mol-0.1mol=2.4mol,
设参加反应生成硝酸的NO物质的量为xmol、二氧化氮的物质的量为ymol,根据N原子守恒及转移电子守恒计算.
解答 解:(1)①根据图知,电解时,左室中电极上氢离子放电生成氢气,则左室为阴极室,右室为阳极室,阳极上通入的是氮氧化物,生成的硝酸,所以阳极上氮氧化物失电子和水生成硝酸,电极反应式为NO2-e-+H2O=NO3-+2H+,
故答案为:NO2-e-+H2O=NO3-+2H+;
②n(NO2)=$\frac{2.24L}{22.4L/mol}$=1.25mol,0.1mol,阳极反应式为NO2-e-+H2O=NO3-+2H+,有0.2mol氢离子生成,因为有0.1mol硝酸生成,则有0.1mol氢离子引入阴极室,故答案为:0.1;
(2)①浓硝酸的物质的量浓度=$\frac{1000ρω}{M}$=$\frac{1000×1.4×63%}{63}$mol/L=14mol/L,根据溶液稀释前后溶质的物质的量不变计算,所以浓硝酸体积=$\frac{0.2mol/L×10L}{14mol/L}$=142.9mL,故答案为:142.9;
②n(H2)=$\frac{28L}{22.4L/mol}$=1.25mol,根据转移电子守恒得转移电子物质的量=1.25mol×2=2.5mol,
电解前溶液中n(HNO3)=0.2mol/L×10L=2mol,电解后溶液中含3mol HNO3、0.1molHNO2,说明电解过程中有1mol HNO3、0.1molHNO2生成,
根据N原子守恒得n(NO)+n(NO2)=3 mol-0.2 mol•L-1×10 L+0.1 mol=1.1 mol,
生成0.1mol亚硝酸转移电子0.1mol且需要0.1mol电子,则生成硝酸转移电子物质的量=2.5mol-0.1mol=2.4mol,
设参加反应生成硝酸的NO物质的量为xmol、二氧化氮的物质的量为ymol,根据N原子守恒及转移电子守恒得
$\left\{\begin{array}{l}{x+y=1.1-0.1}\\{3x+y=2.4}\end{array}\right.$
解得$\left\{\begin{array}{l}{x=0.7}\\{y=0.3}\end{array}\right.$,
n(NO):n(NO2)=(0.7+0.1)mol:0.3mol=8:3,相同条件下气体的体积之比等于物质的量之比,所以NO和二氧化氮的体积之比为8:3,
故答案为,8:3.
点评 本题考查电解原理,为高频考点,侧重考查学生分析计算能力,明确各个电极上发生的反应及反应中存在的守恒是解本题关键,注意(2)②中电解后的硝酸还包含原来的硝酸,为易错点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 实验编号 | HA物质的量浓度(mol•L-1) | NaOH物质的量浓度(mol•L-1) | 混合溶液的pH |
| 甲 | C | 0.2 | pH=7 |
| 乙 | 0.2 | 0.1 | pH=a |
| 丙 | 0.2 | 0.2 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 分子式 | C8H10 | C3H5Cl | C4H8O2 | C4H9ClO |
| 限定条件 | 芳香烃 | 能发生加成反应 | 能与氢氧化钠溶液反应 | 能与钠反应 |
| A. | ③②①④ | B. | ②③①④ | C. | ③①②④ | D. | ②①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第IA族元素铯的同位素137Cs比133Cs多4个质子 | |
| B. | 溴元素的原子序数与氯元素的原子序数差为8 | |
| C. | 卤素元素的阴离子由上到下还原性依次减弱 | |
| D. | 117号元素位于元素周期表中第七周期、第VIIA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+xB(g)?2C(g)达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的关系如图所示.
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+xB(g)?2C(g)达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
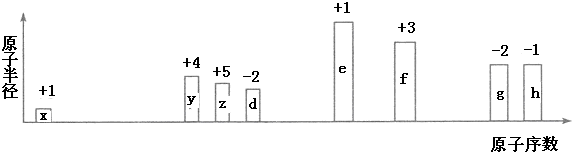
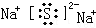 .化合物中离子半径较大的是S2-(填离子符号).
.化合物中离子半径较大的是S2-(填离子符号).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
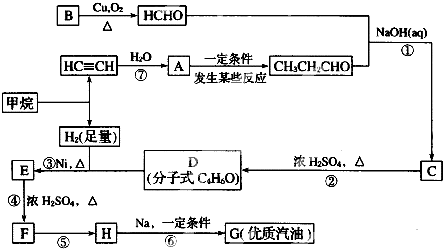
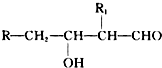
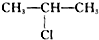
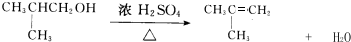 ;H→G
;H→G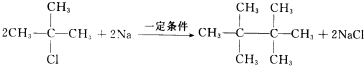 .
.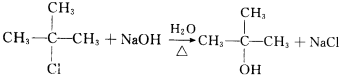 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑤⑦⑧⑨ | B. | ③⑤⑥⑦⑧⑨ | C. | ②③④⑤⑦⑧ | D. | ①②④⑥⑧⑨ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com