
分析 金刚石为原子晶体,晶胞如图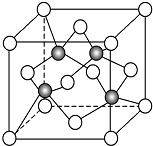 ,根据均摊法计算出晶胞中碳原子数;根据金刚石晶胞的结构,利用立体几何的知识,可以计算晶胞的质量和体积,可计算晶胞的密度,以此解答该题.
,根据均摊法计算出晶胞中碳原子数;根据金刚石晶胞的结构,利用立体几何的知识,可以计算晶胞的质量和体积,可计算晶胞的密度,以此解答该题.
解答 解:金刚石为原子晶体,根据图 可知,C形成4个共价键,则原子配位数是4,根据均摊法可计算出晶胞中碳原子数为$8×\frac{1}{8}+6×\frac{1}{2}+4$=8,则晶胞的质量为$\frac{12×8}{{N}_{A}}$,根据金刚石晶胞的结构可知,晶胞的体对角线为4个碳原子直径的长度,设边长为a,即$\sqrt{3}$a=8r,所以a=$\frac{8\sqrt{3}}{3}$r,而晶胞的体积为a3,
可知,C形成4个共价键,则原子配位数是4,根据均摊法可计算出晶胞中碳原子数为$8×\frac{1}{8}+6×\frac{1}{2}+4$=8,则晶胞的质量为$\frac{12×8}{{N}_{A}}$,根据金刚石晶胞的结构可知,晶胞的体对角线为4个碳原子直径的长度,设边长为a,即$\sqrt{3}$a=8r,所以a=$\frac{8\sqrt{3}}{3}$r,而晶胞的体积为a3,
则密度为$\frac{96}{{N}_{A}(\frac{8\sqrt{3}}{3})^{3}}$=$\frac{3\sqrt{3}}{8{N}_{A}}$,
故答案为:原子;4;$\frac{8\sqrt{3}}{3}$r;$\frac{3\sqrt{3}}{8{N}_{A}}$.
点评 本题考查晶胞计算,为高频考点,侧重考查分析计算及空间想象能力,难点是配位数及密度计算,注意金刚石晶胞中哪些原子紧贴在一起,为易错点.


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | Ca(OH)2 | B. | NaOH | C. | NaHCO3 | D. | Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHS在水中的电离方程式为:NaHS═Na++H++S2- | |
| B. | 已知某温度下Ksp(CH3COOAg)=2.8×10-3,此温度下浓度均为0.1 mol•L-1的AgNO3溶液和CH3COONa溶液等体积混合一定能产生CH3COOAg沉淀 | |
| C. | 0.1mol/L CH3COOH溶液与0.05mol/L NaOH溶液等体积混合,所得溶液中:2c(H+)+c(CH3COOH)=c(CH3COO-)+2c(OH-) | |
| D. | 0.2mol/LNH3•H2O溶液与0.1mol/L盐酸等体积混合后,溶液显碱性,则:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用惰性电极电解MgCl2 溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| B. | 1molN2与3molH2在某密闭容器中反应放出73kJ热量,则反应的热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-73kJ/mol | |
| C. | 将AlCl3溶液与Na2S混合产生沉淀:2Al3++3S2-═Al2S3↓ | |
| D. | 2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l)△H=-akJ•mol-1,则中和热为0.5akJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,则其在周期表中的位置是第四周期,VA族.
,则其在周期表中的位置是第四周期,VA族.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “恶狗酒酸”的成语中涉及了氧化反应 | |
| B. | 饮用的白酒是纯净物,即乙醇 | |
| C. | 酿酒过程中发生了物理变化和化学变化 | |
| D. | 工业酒精中因含有剧毒物质甲醇而不能用来勾兑饮用酒水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com