
在实验室测定碳酸钠与碳酸氢钠的混合物中,碳酸钠的质量分数[用符号w(Na2CO3)表示],称取此混合物5.lg,溶于水中,配成250mL溶液。
a.(10分)方案一:沉淀法测w(Na2CO3)利用化学反应把HCO3-、CO32-完全转化为沉淀,称取沉淀的质量,由此计算混合物中w (Na2CO3)。
(1)量取100 mL配制好的溶液于烧杯中,滴加足量沉淀剂,把溶液中HCO3-、CO32-完全转化为沉淀,应选的试剂是___________ (填编号)。
| A.CaCl2 | B.MgSO4 | C..NaCI | D.Ba(OH)2 |
a(1)D
(2)静止,澄清,然后向上层清液中滴加Ba(0H)2溶液,若有沉淀产生,说明未沉淀完全,反之,则沉淀完全
(3) 烧杯、普通漏斗、玻璃棒
(4) 向漏斗的沉淀上加蒸馏水使其没过沉淀,过滤,重复操作2到3次
(5) 偏小
b(1)碱式滴定管
(2)溶液由红色变为无色,且半分钟内不变色 H++CO32-=HCO3-
(3)83.14
解析试题分析:a(1)A、CaCl2不与HCO3-反应,错误;B、MgSO4不与HCO3-反应,错误;C、NaCI均不反应,错误;D 、Ba(0H)2均反应生成沉淀,正确,答案选D。
(2)溶液中若存在HCO3-、CO32-,则继续滴加Ba(0H)2溶液会有沉淀产生,所以证明HCO3-、CO32-已完全沉淀的实验操作是:静止,澄清,然后向上层清液中滴加Ba(0H)2溶液,若有沉淀产生,说明未沉淀完全,反之,则沉淀完全
(3)过滤操作所需要的玻璃仪器有:烧杯、普通漏斗、玻璃棒
(4)洗涤沉淀的操作是:向漏斗的沉淀上加蒸馏水使其没过沉淀,过滤,重复操作2到3次
(5)沉淀未干燥会导致沉淀的质量增大,从而计算出的碳酸钠的质量减小,所以测得w (Na2CO3)偏小
b((1)(3)每空2分,(2)每空1分)
(1)碳酸钠与碳酸氢钠的溶液显碱性,应用碱式滴定管量取
(2)碳酸钠与碳酸氢钠的溶液显碱性,使酚酞试液变红,所以滴定终点时溶液由红色变为无色,且半分钟内不变色;方案b中用酚酞作指示剂,所以滴定终点时的溶液仍为碱性,即盐酸滴定碳酸钠和碳酸氢钠的混合液时,盐酸与碳酸钠反应生成碳酸氢钠,不产生二氧化碳气体,所以此过程发生的离子方程式为H++CO32-=HCO3-
(3)由(2)知H+~CO32-因此由消耗盐酸的体积可计算出碳酸钠的物质的量n(Na2CO3)=0.2mol/L×20×10-3L=0.004mol,所以原溶液中碳酸钠的质量为
0.004mol×10×106g/mol=4.24g,则w(Na2CO3)=4.24g/5.1g×100%=83.14%
考点:考查试剂的选择,沉淀完全的判断,洗涤操作,误差分析,仪器的选择,质量分数的计算


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:问答题
实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4,主要流程如下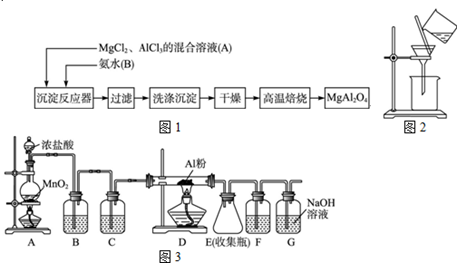
(1)为使Mg2+、Al3+同时生成沉淀,应先向沉淀反应器中加入 (填“A”“B”或),再滴加另一反应物。制备MgAl2O4过程中,高温焙烧时发生反应的化学方程式 。
(2)如下图所示,过滤操作中的一处错误是 。
(3)判断流程中沉淀是否洗净所用的试剂是 ,高温焙烧时,用于盛放固体的仪器名称是 。
(4)无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。装置B中盛放饱和NaCl溶液,该装置的主要作用是 ,F中试剂的作用是 。用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为 ;
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(16分)某研究小组为了探究“铁与水蒸气”的反应的产物,进行了下列实验:用如图所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”(石棉绒高温下不与水和铁反应).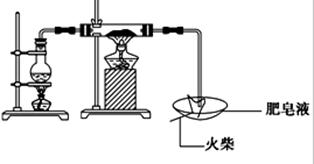
(1)如何检查该装置的气密性:
(2)写出铁与水蒸气反应的化学方程式
(3)验证固体产物中铁元素的价态
限选实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹;1mol/L CuSO4、3mol/L H2SO4、3mol/L HNO3、30%H2O2、0.01mol/L KMnO4、20%KSCN、蒸馏水。
在答题卡上按下表的格式写出实验步骤、预期现象与结论。
| | 实验步骤 | 预期现象与结论 |
| 步骤1 | 取反应后干燥的固体ag于试管中,加入足量的1mol/L CuSO4溶液,充分振荡,经固液分离、洗涤后,再向固体中滴加足量的 ,振荡溶解,过滤后将滤液配成250mL溶液,待用。 | |
| 步骤2 | 取少量步骤1中滤液于试管中, | |
| 步骤3 | 取少量步骤1中滤液于试管中, | |
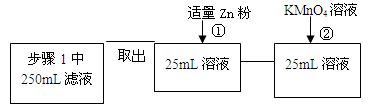
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
一般测定样品中成分含量的实验应重复2~3次。为了测定某氢氧化钠固体中混有的碳
酸钠的质量分数,甲、乙、丙三位同学分别设计了如下实验方案: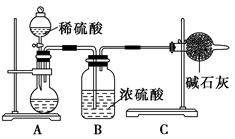
Ⅰ.甲同学的方案如图所示:
(1)如何检验A装置的气密性?___________________________________。
(2)甲同学重复进行了三次实验,得到碳酸钠的质量分数的数据存在较大的偏差,你认为可能引起测量结果偏低的原因是________(填序号)。
A.装置内原有空气中的二氧化碳气体也被碱石灰吸收
B.装置外空气中的水蒸气和二氧化碳被碱石灰吸收
C.反应完成后,装置中的二氧化碳没有全部被碱石灰吸收
D.加入稀硫酸的量不足、反应不充分
(3)为了让甲的实验测量结果更准确,在其他实验步骤都正确的条件下,你认为图中的实验装置应该如何改进:___________________________________________。
Ⅱ.乙同学的方案是:从图中所提供的装置中选择实验装置,代替甲同学实验装置中的B、C,通过测定放出的二氧化碳的体积(不考虑二氧化碳溶于水)来计算。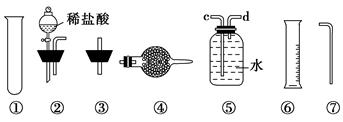
选择最简装置的连接顺序为________。
Ⅲ.丙同学的方案是:称取样品m g,并溶解,加入过量氯化钡溶液,过滤、洗涤、烘干、称量,得固体n g。
(1)配制100 mL 0.10 mol/L BaCl2溶液的实验中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒外还有______(填仪器名称)。
(2)混合物中碳酸钠的质量分数为(用m、n表示)________。
(3)Ca2+、Ba2+都可以使CO32—沉淀完全,能否使用氯化钙溶液代替氯化钡溶液?________(填“能”或“否”),原因是:______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
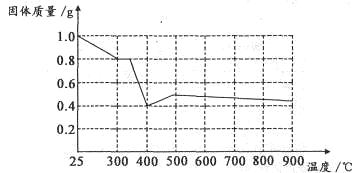
草酸亚铁晶体(FeC2O4·2H2O)用作分析试剂及显影剂和新型电池材料磷酸亚铁锂的生产。回答下列问题:
I.兴趣小组对草酸亚铁晶体的分解产物进行实验和探究。探究分解得到的固体产物中铁元素的存在形式。
(1)提出假设
假设一:___________; 假设二:全部是FeO ; 假设三:FeO和Fe混合物。
(2)设计实验方案证明假设三。
| 实验步骤 | 现象与结论 |
| 步骤1:向试管中加入少量固体产物,再加入足量 ,充分震荡 | 若溶液颜色明显改编,且有 生成,则证明有铁单质存在 |
| 步骤2:将步骤1中得到的浊液过滤,并用蒸馏水洗涤至洗涤液无色 | |
| 步骤3:去步骤2得到少量固体与试管中,滴加 | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:
(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有________、________(填仪器名称)。
(2)写出加入氯水发生反应的离子方程式_____________________________________。
(3)检验沉淀已经洗涤干净的操作及现象是_____________________。
(4)坩埚质量为W1 g,加热后坩埚与红棕色固体总质量为W2 g,则样品中铁元素的质量分数是________ (列出原始算式,不需化简);若称量准确而最终测量的结果偏大,则造成误差的原因可能是_____________________________________________________________
(写出一种原因即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
请根据教材上的实验“钠与氯气反应”,完成下列问题。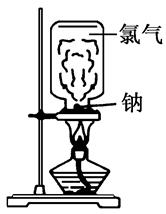
(1)取一块绿豆大的金属钠(切去氧化层),用滤纸吸净其表面的煤油,放在石棉网上,用酒精灯微热。待钠熔成球状时,将盛有氯气的集气瓶迅速倒扣在钠的上方。根据所学的知识分析该实验存在哪些缺点?
①____________________________________________________;
②____________________________________________________;
③________________。(至少填2条)
(2)某同学根据以上存在的缺点改进实验装置,如图所示: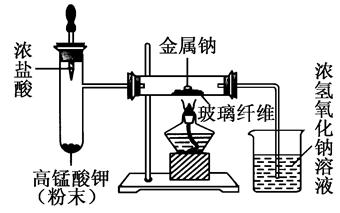
实验步骤:
a.取绿豆粒大的钠,用滤纸吸干表面的煤油,切去氧化层,放入玻璃管中,按图示安装好仪器;
b.慢慢滴加浓盐酸,立即剧烈反应产生氯气;
c.当玻璃管中充满黄绿色气体时,再加热钠,钠熔化并燃烧。
①观察到的实验现象有:当滴加浓盐酸后试管中产生________色气体;钠剧烈燃烧,火焰呈________色且有________生成,反应结束后,管壁上观察到有________生成。
②改进后的实验优点:a.________,b.________,c.______(至少回答2条)。
③写出Na在Cl2中燃烧的化学方程式________________,并用电子式表示产物形成过程________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。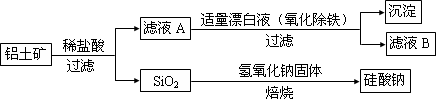
(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①检验滤液B中是否还含有铁元素的方法为: (注明试剂、现象)。
②检验滤液A中是否含有Fe2+的试剂是 ,其实验现象为 。
③由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、冷却结晶、 (填操作名称)、洗涤。
(2)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为 (填代号)。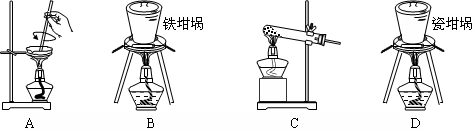
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:
请根据上面流程,回答以下问题:
(1)操作I是配制溶液,所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 、 .(填仪器名称)
(2)下列操作可能使所配溶液浓度偏小的是________________(填写序号)。
①未洗涤烧杯和玻璃棒
②定容时俯视容量瓶的刻度线
③配溶液前容量瓶中有少量蒸馏水
④摇匀后,发现液面低于刻度线后继续加水至凹液面与刻度线相切
(3)请写出加入氯水发生的离子方程式 ,
(4)检验沉淀是否已经洗涤干净的操作是 。
(5)若原样品质量a为50g,加热后红棕色固体质量b为3g,则样品中铁元素的质量分数是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com