
【题目】在元素周期表中金属与非金属的分界处,可以找到
A. 合金 B. 农药 C. 催化剂 D. 半导体材料
 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
【题目】常温下,氯化亚硝酰(NOCl)足一种红黄色气体,其熔点- 64.5℃,沸点-5.5℃,可被水分解,其一种制备原理为Cl2+2NO =2NOC1。实验装置如下图所示,回答下列问题:

(1)实验前须排尽装置I、Ⅱ、Ⅲ中的空气,其原因是__________________________。
(2)NO是用铜与稀硝酸反应制得,其离子方程式为__________________________。
(3)图中各装置连接顺序为a→________________(按气流自左向右方向,用小写字母表示)。
(4)装置I、Ⅱ的作用是观察气泡调节气体的流速和________________________________。
(5)装置V是为了吸收尾气,防止污染环境,其中吸收NOC1时反应的化学方程式为____________(非氧化还原反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子方程式CO32﹣+2H+═H2O+CO2↑中CO32﹣的代表的物质可以是( )
A.CaCO3
B.NaHCO3
C.Na2CO3
D.BaCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关仪器的使用方法或实验操作正确的是( )
A.用碱式滴定管量取13.60mL酸性高锰酸钾溶液
B.测定硫酸铜晶体结晶水含量时,加热后的坩埚须在干燥器中冷却,再称量
C.蒸馏时,应使温度计水银球置于蒸馏液体中
D.过滤时,先将滤纸湿润,然后再将滤纸放入漏斗中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3是一种重要的化工原料,可用来制备肼、硝酸、硝酸铵和氯胺等。
(1)N2和H2以物质的量之比为1∶3在不同温度和压强下发生反应:N2+3H2![]() 2NH3,测得平衡体系中NH3的物质的量分数如右图。
2NH3,测得平衡体系中NH3的物质的量分数如右图。

① 下列途径可提高氨气产率的是________(填字母)。
a. 采用常温条件 b. 采用高温条件
c. 将原料气加压 d. 将氨液化,不断移去液氨
② 右图中所示的平衡体系中NH3的物质的量分数为0.549和0.478时,该反应的平衡常数分别为K1、K2,则K1________(填“>”“<”或“=”)K2。
(2)肼(N2H4)是一种火箭燃料。已知:
N2(g)+2O2(g)===2NO2(g);ΔH=+67.7 kJ·mol-1
N2H4(g)+O2(g)===N2(g)+2H2O(g);ΔH=-534.0 kJ·mol-1
NO2(g)===1/2N2O4(g);ΔH=-28.0 kJ·mol-1
① 反应2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g)的ΔH=________kJ·mol-1。
② 氨气与次氯酸钠溶液反应生成肼的离子方程式为__________________________。
(3)电解硝酸工业的尾气NO可制备NH4NO3,其工作原理如右图。

① 阴极的电极反应式为____________________________________。
② 将电解生成的HNO3全部转化为NH4NO3,则通入的NH3与实际参加反应的NO的物质的量之比至少为________。
(4)饮用水消毒时,氯胺(NH2Cl等)在酸性条件下具有良好的效果(已知:NH2Cl+H2O≒NH3+HClO),其原因是__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如右图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中。下列分析正确的是( )

A. K1闭合,铁棒上发生的反应为2H++2e-→H2↑
B. K1闭合,石墨棒周围溶液pH逐渐升高
C. K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D. K2闭合,电路中通过0.002NA个电子时,两极共产生0.001mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用如图所示装置制备并检验Cl2的性质.下列说法正确的是( ) 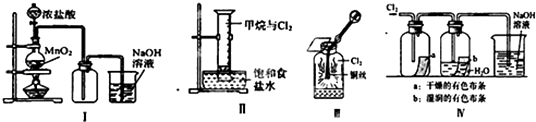
A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部被消耗
B.Ⅱ图中:量筒中发生了加成反应
C.Ⅲ图中:生成蓝色的烟
D.Ⅳ图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com