
| A、2:3 | B、3:4 |
| C、11:3 | D、10:3 |


科目:高中化学 来源: 题型:
| A、c(OH-)=c(Na+)>c(HCOO-)>c(H+) |
| B、c(Na+)=c(HCOO-) |
| C、c(Na+)>c(HCOO-)>c(H+)>c(OH-) |
| D、c(H+)>c(HCOO-)>c(Na+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定产生BaSO4沉淀 |
| B、一定产生BaSO3沉淀 |
| C、一定有BaSO4沉淀 和BaSO3沉淀 |
| D、一定有SO3逸出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CCl4层显紫色是因为有I2生成 |
| B、溶液分两层,紫色层在上层 |
| C、CCl4层显紫色是因为有Cl2生成 |
| D、CCl4层颜色最终会变为无色因为I2会升华 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,1.8 g水中所含有氧原子数目为0.1NA |
| B、常温常压下,2.24L CO2气体中含氧原子数目为0.2NA |
| C、0.1 mol/LCuCl2溶液中,含有Cl-离子的数目为0.2NA |
| D、常温常压下,2.3 g Na+中含有的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
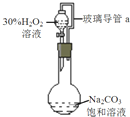 过碳酸钠是一种集洗涤、漂白、杀菌于一体的氧系漂白剂,化学式可表示为aNa2CO3?bH2O2,具有Na2CO3和H2O2的性质.某化学兴趣小组进行如下实验:
过碳酸钠是一种集洗涤、漂白、杀菌于一体的氧系漂白剂,化学式可表示为aNa2CO3?bH2O2,具有Na2CO3和H2O2的性质.某化学兴趣小组进行如下实验:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com