
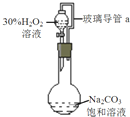
 过碳酸钠是一种集洗涤、漂白、杀菌于一体的氧系漂白剂,化学式可表示为aNa2CO3?bH2O2,具有Na2CO3和H2O2的性质.某化学兴趣小组进行如下实验:
过碳酸钠是一种集洗涤、漂白、杀菌于一体的氧系漂白剂,化学式可表示为aNa2CO3?bH2O2,具有Na2CO3和H2O2的性质.某化学兴趣小组进行如下实验:
| ||
| ||
34g/mol×(6.000×10-4mol×
| ||
| 0.2000g |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、2:3 | B、3:4 |
| C、11:3 | D、10:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将乙烯和乙炔气体分别通入溴的四氯化碳溶液中前者退色,后者不退色 |
| B、甲烷和氯气在室温下的黑暗环境中可以稳定存在 |
| C、苯能使溴水退色是因为二者反应生成了溴苯 |
| D、要除去乙烷中的乙烯制得纯净的乙烷,可将混合气通入酸性高锰酸钾溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图为用惰性电极电解CuCl2溶液,并验证其产物的实验装置,回答下问题:
如图为用惰性电极电解CuCl2溶液,并验证其产物的实验装置,回答下问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
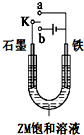 X、Y、Z、W为按原子序数由小到大排列的四种短周期元素.已知:①X可分别与Y、W形成X2Y、X2Y2、XW等共价化合物;②Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物.请回答:
X、Y、Z、W为按原子序数由小到大排列的四种短周期元素.已知:①X可分别与Y、W形成X2Y、X2Y2、XW等共价化合物;②Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com