
| m |
| M |
| 28g |
| 56g/mol |
| 72g |
| 18g/mol |


 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案科目:高中化学 来源: 题型:
| A、CCl4层显紫色是因为有I2生成 |
| B、溶液分两层,紫色层在上层 |
| C、CCl4层显紫色是因为有Cl2生成 |
| D、CCl4层颜色最终会变为无色因为I2会升华 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.25mol |
| B、2mol |
| C、2.5mol |
| D、4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
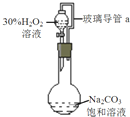 过碳酸钠是一种集洗涤、漂白、杀菌于一体的氧系漂白剂,化学式可表示为aNa2CO3?bH2O2,具有Na2CO3和H2O2的性质.某化学兴趣小组进行如下实验:
过碳酸钠是一种集洗涤、漂白、杀菌于一体的氧系漂白剂,化学式可表示为aNa2CO3?bH2O2,具有Na2CO3和H2O2的性质.某化学兴趣小组进行如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com