
| ||
| ||
| ||
| ||


科目:高中化学 来源: 题型:
| A、1 mol 金属钠含有的电子数 |
| B、标准状况下,22.4 L 苯所含的分子数 |
| C、0.012 kg 12C所含的原子数 |
| D、1 L 1 mol?L-1硫酸溶液所含的H+数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图表示500℃时,X、Y、Z三种气体在容积固定的容器中反应,各物质的浓度随时间的变化情况.达到平衡后,改变压强,平衡不移动.下列说法中正确的是( )
如图表示500℃时,X、Y、Z三种气体在容积固定的容器中反应,各物质的浓度随时间的变化情况.达到平衡后,改变压强,平衡不移动.下列说法中正确的是( )| A、Z物质的变化情况为曲线b |
| B、该反应的化学方程式为:2X(g)?3Y(g)+Z(g) |
| C、0→t1,X的物质的量浓度变化量为1.2mol/L |
| D、若t1=1min,则v(Y )=0.02mol?L-1?s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将乙烯和乙炔气体分别通入溴的四氯化碳溶液中前者退色,后者不退色 |
| B、甲烷和氯气在室温下的黑暗环境中可以稳定存在 |
| C、苯能使溴水退色是因为二者反应生成了溴苯 |
| D、要除去乙烷中的乙烯制得纯净的乙烷,可将混合气通入酸性高锰酸钾溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
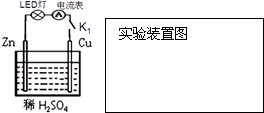 (1)原电池是一种将
(1)原电池是一种将查看答案和解析>>
科目:高中化学 来源: 题型:
 如图为用惰性电极电解CuCl2溶液,并验证其产物的实验装置,回答下问题:
如图为用惰性电极电解CuCl2溶液,并验证其产物的实验装置,回答下问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
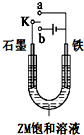 X、Y、Z、W为按原子序数由小到大排列的四种短周期元素.已知:①X可分别与Y、W形成X2Y、X2Y2、XW等共价化合物;②Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物.请回答:
X、Y、Z、W为按原子序数由小到大排列的四种短周期元素.已知:①X可分别与Y、W形成X2Y、X2Y2、XW等共价化合物;②Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com