
(本题共12分)
我国利用生产磷铵[(NH4)3PO4]排放的废渣磷灰石制取硫酸并联产水泥的技术研究获得成功。已知磷灰石的主要成分是Ca3(PO4)2,具体生产磷铵流程如下:
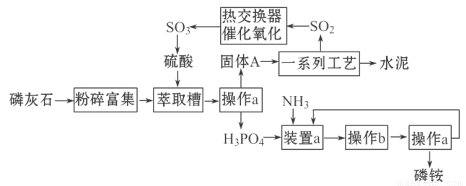
38.操作a的名称是___________,实验室中进行此操作的非玻璃仪器用品有___________;在实验室中操作b的名称是______________________。
39.装置a中生成两种酸式盐,它们的化学式分别是_______________________。
40.固体A中一定含有的物质,其化学式是_________________。
41.热交换器是实现冷热交换的装置。化学实验中也经常利用热交换来实现某种实验目的,气、液热交换时通常使用的仪器是________________________。
42. 制硫酸所产生的尾气除了含有N2、O2外,还含有SO2,微量的SO3和酸雾。能用于测定硫酸尾气中SO2含量的试剂是__________。
a.NaOH溶液、酚酞试液 b.KMnO4溶液、稀硫酸
c. 碘水、淀粉溶液 d.氨水、酚酞试液
所用的测量方法为 。
38. 过滤 (1分) 铁架台(含铁圈)、滤纸 (1分) 蒸发浓缩、冷却结晶(2分)
39. NH4H2PO4、(NH4)2HPO4 (2分)
40. CaSO4·2H2O (2分)
41. 冷凝管 (1分)
42. b、c (2分) (氧化还原)滴定法(1分)
【解析】
试题分析:38.固液分离用过滤操作,操作中用到漏斗、玻璃棒、烧杯和铁架台、滤纸等;从滤液中得到晶体应采用蒸发浓缩、冷却结晶的方法,铵盐稳定性差,不宜采用蒸发结晶;39.磷酸为三元酸,生成两种酸式盐;40.磷酸钙与硫酸反应生成磷酸和硫酸钙,故A中一定含有硫酸钙晶体;42.利用SO2的还原性采用滴定法测定其含量,可以用氧化剂酸性KMnO4溶液、碘水等氧化。
考点:考查工业流程中物质的制备、分离、分析等有关问题。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案科目:高中化学 来源:2013-2014云南省高二下学期第二次月考化学试卷(解析版) 题型:选择题
常温时,下列叙述正确的是
A. pH=9的NH4Cl与NH3?H2O混合溶液中c(Cl-)>c(NH4+)
B. pH=2.5的可乐中c(H+) 是pH=3.5的柠檬水中c(H+)的10倍
C. AgCl在0.1mol /L CaCl2溶液和0.1mol/L NaCl溶液中的溶解度相同
D. 1 mL 1mol /L Na2CO3溶液加水稀释至100mL, pH和Kw均减小
查看答案和解析>>
科目:高中化学 来源:2013-2014云南省高一下学期期末考试化学试卷(解析版) 题型:选择题
使1mol乙烯与氯气发生完全加成反应,然后使该加成反应的产物与氯气在光照的条件下发生取代反应,则两个过程中消耗的氯气的总的物质的量是
A.3mol B.4mol C.5mol D.6mol
查看答案和解析>>
科目:高中化学 来源:2013-2014云南省昭通市毕业生复习统一检测理科综合化学试卷(解析版) 题型:填空题
(14分)

明矾[KAl(SO4)2·12H2O] 在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al 、 Al2O3及少量SiO2和FeO ·xFe2O3)可制备明矾。工艺流程如下:
回答下列问题:
(1)明矾净水的原理是(用离子方程表示)
(2)操作Ⅰ是 ,操作Ⅱ是蒸发浓缩、 、过滤、 干燥。
(3)检验滤液A中是否存在Fe2+的方法是 (只用一种试剂)
(4)在滤液A中加入高锰酸钾的目的是 ,发生反应的离子方程式为(该条件下Fe2+ 转化为Fe3+,MnO4- 转化为Mn2+) 。
已知:生成氢氧化物沉淀的pH如下表所示
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
开始沉淀时 | 3.4 | 6.3 | 1.5 |
完全沉淀时 | 4.7 | 8.3 | 2.8 |
注:金属离子的起始浓度为0.1 mol·L-1
根据表中数据解释调pH=3的目的 。
(5)己知:在pH=3、加热条件下,MnO4- 可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为: 。滤渣2含有的物质是 。
(6)以Al和NiO(OH)为电极,KOH溶液为电解液可组成新型、高效电池,充放电过程中,发生Ni(OH)2与NiO(OH)之间的转化,写出放电时电池反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2013-2014云南省昭通市毕业生复习统一检测理科综合化学试卷(解析版) 题型:选择题
某有机物的结构简式如图所示,下列关于该物质的性质描述正确的是

A.不能使溴的四氯化碳溶液褪色
B.能发生缩聚反应
C.既能发生消去反应,也能发生取代反应
D.1 mol该物质最多可与5mol NaOH反应
查看答案和解析>>
科目:高中化学 来源:2013-2014上海市黄浦区高三二模化学试卷(解析版) 题型:选择题
实验室中配制碘水,往往是将I2溶于KI溶液中,即可得到浓度较大的碘水,原因是发生了反应:I2(aq)+I-(aq) I3-(aq)。在反应的平衡体系中,c(I3-)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态)。
I3-(aq)。在反应的平衡体系中,c(I3-)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态)。

下列说法正确的是
A.该反应的正反应为放热反应
B.A状态与C状态的化学反应速率大小为v(A)>v(C)
C.D状态时,v正>v逆
D.欲配制浓度较大的氯水,可将氯气通入氯化钾溶液中
查看答案和解析>>
科目:高中化学 来源:2013-2014上海市黄浦区高三二模化学试卷(解析版) 题型:选择题
有4种金属a、b、c、d,它们与浓HNO3反应时,只有a不反应;往这4种金属粉末的混合物中加入盐酸,其中b、c溶解,过滤后,在滤液中加入过量的NaOH溶液,可得到c离子的沉淀,则这4种金属的活动性强弱的顺序可能是
A.c > b > d > a B.b > a > d > c C.a > b > c > d D.d > c > b > a
查看答案和解析>>
科目:高中化学 来源:2013-2014上海市静安区第二学期高二学业水平测试化学试卷(解析版) 题型:实验题
硫代硫酸钠的纯度可用滴定法进行测定,原理是:2S2O32-+ I2 → S4O62-+ 2I-
38. 配制100 mL0.0500 mol/L I2溶液,不需要的仪器是 (选填编号)。
a.100 mL容量瓶 b.量筒 c.烧杯 d.玻璃棒
滴定管标有使用温度:20oC; 滴定管的最小刻度为 mL。
39.取2 .500g含杂质的Na2S2O3·5H2O晶体配成50mL溶液,每次取10.00mL放入锥形瓶里,加2滴淀粉为指示剂,再用0.0500 mol/L I2溶液滴定,实验数据如下(第3次初读数为 0.00,终点读数如图; 杂质不参加反应):

编号 | 1 | 2 | 3 |
消耗I2溶液的体积/mL | 19.98 | 20.02 |
|
到达滴定终点的现象是 ;
Na2S2O3?5H2O(式量248)的质量分数是(保留4位小数) 。
40.会造成实验结果偏低的操作是 (选填编号)。
a. 滴定时滴定管中的液体滴在锥形瓶外
b. 锥形瓶用蒸馏水洗净后,立即装入待测溶液
c. 未用标准液润洗滴定管
d. 振荡时溶液溅出锥形瓶外
查看答案和解析>>
科目:高中化学 来源:2013-2014上海市宝山区高二年级化学学科质量监测化学试卷(解析版) 题型:选择题
在100mL0.1mol/L醋酸溶液中加入以下物质中的一种,醋酸溶液pH变小。所加入的这种物质是
A.水 B. 0.1mol/L盐酸
C. 醋酸钠晶体 D. 0.1mol/L氢氧化钠溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com