
(14分)

明矾[KAl(SO4)2·12H2O] 在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al 、 Al2O3及少量SiO2和FeO ·xFe2O3)可制备明矾。工艺流程如下:
回答下列问题:
(1)明矾净水的原理是(用离子方程表示)
(2)操作Ⅰ是 ,操作Ⅱ是蒸发浓缩、 、过滤、 干燥。
(3)检验滤液A中是否存在Fe2+的方法是 (只用一种试剂)
(4)在滤液A中加入高锰酸钾的目的是 ,发生反应的离子方程式为(该条件下Fe2+ 转化为Fe3+,MnO4- 转化为Mn2+) 。
已知:生成氢氧化物沉淀的pH如下表所示
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
开始沉淀时 | 3.4 | 6.3 | 1.5 |
完全沉淀时 | 4.7 | 8.3 | 2.8 |
注:金属离子的起始浓度为0.1 mol·L-1
根据表中数据解释调pH=3的目的 。
(5)己知:在pH=3、加热条件下,MnO4- 可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为: 。滤渣2含有的物质是 。
(6)以Al和NiO(OH)为电极,KOH溶液为电解液可组成新型、高效电池,充放电过程中,发生Ni(OH)2与NiO(OH)之间的转化,写出放电时电池反应的化学方程式 。
(1) Al3+ +3H2O  Al(OH)3 +3H+ ;(2)过滤 冷却结晶 洗涤
Al(OH)3 +3H+ ;(2)过滤 冷却结晶 洗涤
(3)取适量滤液A于试管中,滴加铁氰化钾溶液,产生蓝色沉淀,证明Fe2+存在。
(4)使Fe2+转化为Fe3+ ;5Fe2+ +MnO4- +8H+ ==5Fe3+ +Mn2+ +4H2O;使Fe3+转化成Fe(OH)3沉淀
(5)3Mn2+ +2MnO4- +2H2O=5MnO2 +4H+; MnO2 Fe(OH)3
(6) Al+3NiO(OH)+KOH +H2O=KAlO2+3Ni(OH)2
【解析】
试题分析:(1)明矾是强酸弱碱盐,弱酸根离子Al3+水解产生氢氧化铝胶体,能够吸附水中悬浮的物质形成沉淀而除去,从而达到达到净水的目的。其反应原理用方程式表示是Al3+ +3H2O  Al(OH)3 +3H+ ;(2)操作Ⅰ是将难溶性固体与溶液分离的操作,叫过滤。操作Ⅱ是蒸发浓缩、冷却结晶、过滤、洗涤、干燥就得到明矾。(3)检验滤液A中是否存在Fe2+的方法是取适量滤液A于试管中,滴加铁氰化钾溶液,产生蓝色沉淀,证明Fe2+存在。或加入KSCN溶液,无明显变化,在滴加几滴H2O2溶液,溶液变为血红色,就证明含有Fe2+存在。(4)在滤液A中加入高锰酸钾的目的是使Fe2+转化为Fe3+;发生反应的离子方程式为5Fe2+ +MnO4- +8H+ ==5Fe3+ +Mn2+ +4H2O;;根据表中数据可知当溶液的pH=3时Fe3+可以形成沉淀Fe(OH)3。(5)根据题意可得方程式3Mn2+ +2MnO4- +2H2O=5MnO2 +4H+; 由于溶液的pH=3,所以滤渣的成分含有MnO2和 Fe(OH)3。(6)根据题意结合反应条件可知:在放电时,电池反应的化学方程式Al+3NiO(OH)+ KOH +H2O=KAlO2+3Ni(OH)2。
Al(OH)3 +3H+ ;(2)操作Ⅰ是将难溶性固体与溶液分离的操作,叫过滤。操作Ⅱ是蒸发浓缩、冷却结晶、过滤、洗涤、干燥就得到明矾。(3)检验滤液A中是否存在Fe2+的方法是取适量滤液A于试管中,滴加铁氰化钾溶液,产生蓝色沉淀,证明Fe2+存在。或加入KSCN溶液,无明显变化,在滴加几滴H2O2溶液,溶液变为血红色,就证明含有Fe2+存在。(4)在滤液A中加入高锰酸钾的目的是使Fe2+转化为Fe3+;发生反应的离子方程式为5Fe2+ +MnO4- +8H+ ==5Fe3+ +Mn2+ +4H2O;;根据表中数据可知当溶液的pH=3时Fe3+可以形成沉淀Fe(OH)3。(5)根据题意可得方程式3Mn2+ +2MnO4- +2H2O=5MnO2 +4H+; 由于溶液的pH=3,所以滤渣的成分含有MnO2和 Fe(OH)3。(6)根据题意结合反应条件可知:在放电时,电池反应的化学方程式Al+3NiO(OH)+ KOH +H2O=KAlO2+3Ni(OH)2。
考点:考查盐的水解、混合物的分离、离子的检验、离子方程式的书写、原电池反应原理及应用的知识。


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源:2013-2014云南省高二下学期第二次月考化学试卷(解析版) 题型:选择题
X、Y、Z、W是短周期元素,X元素原子的最外层未达到8电子稳定结构,工业上通过分离液态空气获得其单质;Y元素原子最外电子层上s、p电子数相等;Z元素+2价阳离子的核外电子排布与氖原子相同;W元素原子的M层有1个未成对的p电子。下列有关这些元素性质的说法一定正确的是
A.X元素的氢化物的水溶液显碱性
B.Z元素的单质在一定条件下能与X元素的单质反应
C.Z元素的离子半径大于W元素的离子半径
D.Y元素最高价氧化物的晶体具有很高的熔点和沸点
查看答案和解析>>
科目:高中化学 来源:2013-2014云南省高一下学期期末考试化学试卷(解析版) 题型:选择题
类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是
| 已知 | 类推 |
A. | 将Fe加入CuSO4溶液中 Fe+Cu2+=Cu+Fe2+ | 将Na加入到CuSO4溶液中 2Na+Cu2+=Cu+2Na+ |
B. | 向稀硫酸中加入NaOH溶液至中性 H++OH-=H2O | 向H2SO4溶液中加入Ba(OH)2溶液至中性 H++OH-=H2O |
C. | 向氯化铝溶液中加入足量NaOH溶液 Al3+ + 4OH- = AlO2- + 2H2O | 向氯化铝溶液中加入足量氨水 Al3+ + 4NH3·H2O = AlO2- + 2H2O +4NH4+ |
D. | 向Ca(OH)2溶液中通入过量CO2 CO2 + OH- = HCO3- | 向Ca(OH)2溶液中通入过量SO2 SO2 + OH- = HSO3- |
查看答案和解析>>
科目:高中化学 来源:2013-2014云南省高一下学期期末考试化学试卷(解析版) 题型:选择题
下列广告语对应商品中含有的物质有误的是
A.“红梅味精,领先(鲜)一步 ” ——蛋白质
B.“衡水老白干,喝出男人味”——乙醇
C.“吃了钙中钙,腰不疼了,腿不痛了,腰杆也直了”——碳酸钙
D.“要想皮肤好,早晚用大宝”——丙三醇
查看答案和解析>>
科目:高中化学 来源:2013-2014云南省昭通市毕业生复习统一检测理科综合化学试卷(解析版) 题型:选择题
四种短周期元素W、R、P、Q的原子序数依次增大,W的一种核素没有中子,R、Q同主族,R元素原子的最外层电子数是内层电子数的3倍,P元素与R元素形成的常见化合物中既含离子键又含非极性共价键。下列说法不正确的是
A.沸点:W2R>W2Q B.P与R形成化合物中,阴、阳离子个数比一定为1:2
C.原子半径:W<R<Q<P D.Q元素形成的酸一定是强酸
查看答案和解析>>
科目:高中化学 来源:2013-2014上海市黄浦区高三二模化学试卷(解析版) 题型:实验题
(本题共12分)
我国利用生产磷铵[(NH4)3PO4]排放的废渣磷灰石制取硫酸并联产水泥的技术研究获得成功。已知磷灰石的主要成分是Ca3(PO4)2,具体生产磷铵流程如下:
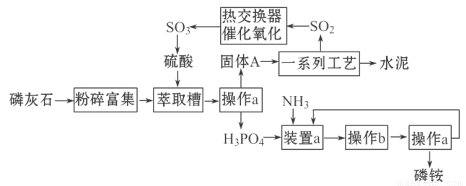
38.操作a的名称是___________,实验室中进行此操作的非玻璃仪器用品有___________;在实验室中操作b的名称是______________________。
39.装置a中生成两种酸式盐,它们的化学式分别是_______________________。
40.固体A中一定含有的物质,其化学式是_________________。
41.热交换器是实现冷热交换的装置。化学实验中也经常利用热交换来实现某种实验目的,气、液热交换时通常使用的仪器是________________________。
42. 制硫酸所产生的尾气除了含有N2、O2外,还含有SO2,微量的SO3和酸雾。能用于测定硫酸尾气中SO2含量的试剂是__________。
a.NaOH溶液、酚酞试液 b.KMnO4溶液、稀硫酸
c. 碘水、淀粉溶液 d.氨水、酚酞试液
所用的测量方法为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014上海市黄浦区高三二模化学试卷(解析版) 题型:选择题
建筑用的红砖和青砖,其颜色是由其中含有的不同价态的铁氧化物所致。我国古代砖瓦建筑能够保持到现在的,几乎无一例外的是由青砖建成。有人提出以下可能的原因:
①青砖中含的是FeO;②青砖中含的是Fe3O4;③Fe2O3遇长期酸雨侵蚀会风化溶解使砖瓦强度降低;④Fe3O4性质稳定;⑤FeO性质稳定。你认为有道理的是
A.①③⑤ B.②③④ C.③⑤ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源:2013-2014上海市宝山区高二年级化学学科质量监测化学试卷(解析版) 题型:实验题
下面的框图是测定CuSO4·xH2O中结晶水含量的实验流程。

40. 填写流程中空白的操作名称:(操作II)_____________; (操作V)___________________。
41. 其加热装置正确的是____________(填写编号)。
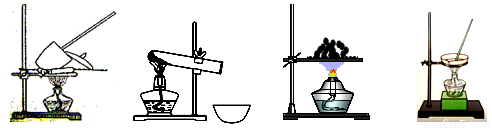
a b c d
42. 重复操作II、III、IV,直到连续两次称量结果相差不超过______g。
43. 操作III必须要在_______(填仪器名称)中进行。
44. 以下胆矾结晶水含量的测定操作正确的是____________(填写编号)。
a. 加热时,晶体溅出坩埚,再加些胆矾
b. 加热时,先用小火,后用大火加热至最后
c. 加热时,不断用玻璃棒搅拌
45. 若实验测得的硫酸铜晶体中结晶水含量偏高,可能的原因有__________(填写编号,下同);若实验测得的硫酸铜晶体中结晶水含量偏低,可能的原因有____________。
a.晶体未完全变白就停止加热
b.加热过程中有少量晶体溅出
c.加热后在空气中自然冷却
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com