
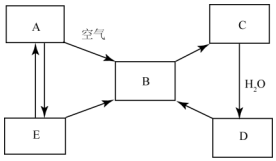
 如图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B气体具有漂白性,可用于漂白纸张、草编织品等,且B和C的相对分子质量之比为4:5,化合物D是重要的工业原料,E是具有臭鸡蛋气味的气体.
如图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B气体具有漂白性,可用于漂白纸张、草编织品等,且B和C的相对分子质量之比为4:5,化合物D是重要的工业原料,E是具有臭鸡蛋气味的气体.分析 E是具有臭鸡蛋气味的气体,应为H2S,可知A为S,B气体具有漂白性,为SO2,B和C的相对分子质量之比为4:5,则C为SO3,E为H2SO4,结合物质的性质以及题目要求可解答该题.
解答 解:(1)实验室用FeS与酸反应制备硫化氢,方程式为FeS+2H+=H2S↑+Fe2+,H2S为二元弱酸,电离方程式为H2S?H++HS-,
故答案为:FeS+2H+=H2S↑+Fe2+;H2S?H++HS-;
(2)Cl2和SO2都具有漂白性,但将这两种气体按体积比1:1,发生的反应为SO2+Cl2+2H2O=4H++SO42-+2Cl-,得到的溶液却几乎没有漂白性,
故答案为:减弱;
(3)工业在吸收塔中用三氧化硫和水反应制备硫酸,因反应生成酸雾,一般用98%的浓硫酸吸收三氧化硫,
故答案为:吸收塔;98%的浓硫酸;防止生成酸雾;
(4)反应为:2H2S+3O2=2SO2+2H2O(g) ①
2H2S+O2=2S+2H2O(g) ②
当$\frac{n(H2S)}{n(O2)}$不同时,根据反应的数轴分析: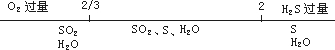
当SO2、S同时有时;①、②反应都发生,a取值必为$\frac{2}{3}$<a<2.
设反应过程是向a L H2S中逐渐通入O2,先发生反应②,O2未用完.所生成物量用H2S计算:即S=a mol,H2O=a mol,
耗O2=$\frac{a}{2}$mol,余O2=(1-$\frac{a}{2}$) mol,而过量O2可与S反应:S+O2═SO2 ③
由反应可知,生成n(SO2)=n(O2)=(1-$\frac{a}{2}$) mol.剩余amolS,
反应生成气体总量为n(SO2)+n(H2O)=1-$\frac{a}{2}$+a=(1+$\frac{a}{2}$)mol
故答案为:$\frac{2}{3}$<a<2;$\frac{a}{2}$;1+$\frac{a}{2}$.
点评 本题考查无机物的推断,为高考常见题型,答题时注意常见物质的物理特性以及典型的化学性质或用途,可以此作为该题的突破口进行推断,注意把握物质的化学性质,能熟练书写反应的化学方程式.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | +867kJ•mol-1 | B. | -867kJ•mol-1 | C. | +1734kJ•mol-1 | D. | -1734kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A的质量分数增加 | B. | 平衡正向移动 | ||
| C. | 化学计量数:m+n=3 | D. | 物质C的体积分数减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液 | B. | Na2CO3溶液 | C. | 石蕊试液 | D. | Cu(OH)2悬浊液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在共价化合物中也可能含有离子键 | |
| B. | 非金属之间形成的化学键一定是共价键 | |
| C. | 含有离子键的化合物一定是离子化合物 | |
| D. | 含有金属元素的离子一定是阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分别将它们配制成溶液,再加入澄清石灰水 | |
| B. | 分别将它们配制成溶液,再加入NaOH溶液 | |
| C. | 分别将它们配制成溶液,再加入CaCl2溶液 | |
| D. | 分别将它们配制成溶液,再进行焰色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向0.1mol/L、pH=1的NaHA溶液中加入NaOH溶液,则离子方程式为:HA-+OH-=A2-+H2O | |
| B. | 室温时,1.0L、pH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA | |
| C. | 由水电离出的c(H+)=1×10-12mol/L的溶液中可能大量存在K+、I-、Mg2+、NO3- | |
| D. | 向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液使SO42-完全沉淀:NH4++Al3++2SO42-+2Ba2++4OH-=NH3•H2O+Al(OH)3↓+2BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 白磷转化为红磷是吸热反应 | B. | 白磷比红磷稳定 | ||
| C. | 红磷转化为白磷为吸热反应 | D. | 红磷比白磷稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com