
【题目】下列各组物质中,第一种是酸,第二种是混合物,第三种是碱的是
A.空气、硫酸铜、H2SO4 B.HCl、Fe(OH)3胶体、纯碱
C.二氧化碳、胆矾、氢氧化钾 D.HNO3、食盐水、烧碱
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.体积相同、浓度均为0.1 mol·L-1的NaOH溶液、氨水,分别稀释m倍、n倍,溶液的pH都变成9,则m<n
B.有甲、乙两氨水溶液,测得甲的pH=a,乙的pH=a+1,则甲乙两溶液c(H+)之比为10:1
C.相同温度下,0.2 mol·L-1乙酸溶液与0.1 mol·L-1乙酸溶液中c(H+)之比为2∶1
D.已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为α,K=![]() 。若加入少量醋酸钠固体,则CH3COOHCH3COO-+H+向左移动,α减小,K变小
。若加入少量醋酸钠固体,则CH3COOHCH3COO-+H+向左移动,α减小,K变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】书写下列方程式:
(1)乙酸和乙醇的酯化反应方程式
(2)工业冶炼镁的化学方程式
(3)二氧化硅与氢氟酸化学方程式
(4)Na2SO3与FeCl3反应的离子方程式
(5)火法炼铜化学方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验题。查阅资料知:Br2的沸点为58.8℃,密度为3.119g·cm-3微溶于水,有毒。
Ⅰ.(1)常温下,单质溴通常呈 态,保存时通常在盛溴的试剂瓶中加入少量 。
Ⅱ.工业生产中,海水提取溴常用空气吹出法。其生产流程可用下图表示:
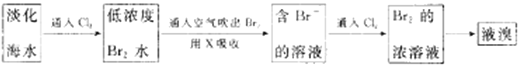
某化学实验小组模拟该法设计了如下实验装置(夹持装置略去)从浓缩的海水中提取液溴
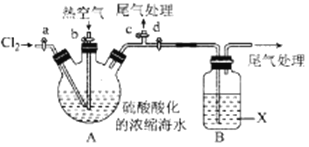
实验步骤如下:
① 关闭活塞b、d,打开活塞a、c,向A中缓慢通入Cl2至反应结束;
② 关闭a、c,打开b、d,向A中鼓入足量热空气;
③ 关闭b,打开a,再通过A向B中通入足量的Cl2;
④ 将B中所得液体进行蒸馏,收集液溴。
(2)当观察到A中液面上方出现 (实验现象)即可判断步骤①中反应已经结束。
(3)X试剂可以是 (填序号),尾气处理选用 (填序号)。
a.H2O b.饱和食盐水 c.氢氧化钠溶液 D.饱和Na2SO3溶液
B中X试剂发生反应的离子方程式为 。
(4)蒸馏时应该选择 ,操作中应控制的关键实验条件为 。
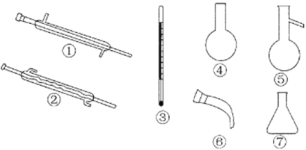
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化镁、氧化铝的熔点高,常作耐高温材料。以MgC12和AlCl3的混合液为主要原料,设计实验制备氧化镁、氧化铝。实验步骤如下:
Ⅰ.取混合液于烧杯中,加入过量的氢氧化钠溶液,充分搅拌,静置;
Ⅱ.过滤得到沉淀和滤液;洗涤、灼烧,得到固体X;
Ⅲ.在步骤Ⅱ所得滤液中加人足量盐酸,再滴加过量的浓氨水;
Ⅳ.过滤、洗涤、灼烧,得到固体Y 。
(1)固体X的名称是_______。
(2)写出步骤Ⅰ中的离子反应方程式:________;________。
(3)步骤Ⅱ过滤中使用的三种玻璃仪器分别为烧杯、漏斗、______。
(4)步骤Ⅲ中,能否使用氢氧化钠溶液替代浓氨水_____(填“能”或“否”)。
(5)写出步骤Ⅳ中“灼烧”发生的化学反应方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】建筑工地常用的NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生反应,反应物生成物有:NaNO2、NO、I2、NaI、H2O、HI。
(1)写出化学反应方程式并用双线桥标出电子转移情况:________。
(2)还原产物是_________;若反应中转移电子总数为4NA时,发生氧化反应的物质的物质的量是_______。
(3)根据上述反应,可用试纸和生活中常见的物质进行实验,以鉴别NaNO2和NaCl,可选用的物质有:
①水;②碘化钾淀粉试纸;③淀粉;④白酒;⑤食醋。下列选项合适的是( )
A.③⑤ B.①②④ C.①②⑤ D.①②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Na2SO4和Al2(SO4)3的混合溶液中,测得Al3+浓度为0.1 mol/L,加入等体积0.3 mol/L的BaCl2溶液恰好使SO42-完全沉淀,则原混合溶液中Na+的浓度为
A.0.3 mol/L B.0.45mol/L C.0.6mol/L D.0.15mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在人们即将步人“5G”时代时,以光导纤维为基础的高速信息通道尤为重要。制造光导纤维的材料是
A. 铜合金 B. 橡胶 C. 聚乙烯 D. 二氧化硅
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com