
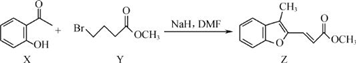
| A. | 物质 X在空气中不易被氧化 | |
| B. | 物质 Y中只含一个手性碳原子 | |
| C. | 物质 Z中所有碳原子不可能在同一平面内 | |
| D. | 等物质的量的 X、Y分别与 NaOH反应,最多消耗 NaOH的物质的量之比为 1:2 |
分析 A.X中含有酚羟基,易被氧化;
B.连接四个不同原子或原子团的C原子为手性碳原子;
C.Z结构中含有苯环、碳碳双键、碳氧双键,具有苯和乙烯结构特点;
D.X中只有酚羟基能和NaOH反应,Y中酯基水解生成的羧基能和NaOH反应,溴原子水解生成的HBr能和NaOH反应.
解答 解:A.X中含有酚羟基,性质不稳定,易被氧气氧化,故A错误;
B.连接四个不同原子或原子团的C原子为手性碳原子,该分子中没有手性碳原子,故B错误;
C.Z结构中含有苯环、碳碳双键、碳氧双键,具有苯和乙烯结构特点,物质Z中所有碳原子可能在同一平面内,故C错误;
D.X中只有酚羟基能和NaOH反应,Y中酯基水解生成的羧基能和NaOH反应,溴原子水解生成的HBr能和NaOH反应,所以等物质的量的X、Y分别与NaOH反应,最多消耗NaOH的物质的量之比为1:2,故D正确;
故选D.
点评 本题考查有机物结构和性质,题目难度中等,明确官能团及其性质关系是解本题关键,侧重考查学生分析判断能力,注意C采用知识迁移方法解答,注意D中溴原子水解生成的HBr能和NaOH反应,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 物质不是电解质就是非电解质 | |
| B. | 酸性氧化物不一定都是非金属氧化物,而非金属氧化物一定是酸性氧化物 | |
| C. | 能导电的物质不一定是电解质,电解质不一定能导电 | |
| D. | 液氨溶于水能导电,所以是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
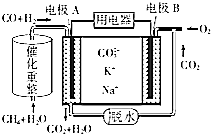 CH4和H2O(g)可发生催化重整反应:CH4(g)+H2O(g)?CO(g)+3H2(g).
CH4和H2O(g)可发生催化重整反应:CH4(g)+H2O(g)?CO(g)+3H2(g).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)实验室配制1000mL0.50mol•L-1的Na2CO3溶液,在常用仪器中应选用1000mL的容量瓶,称量时若将法码放在左盘(1g以下用游码),则配制的溶液的物质的量浓度等于0.50mol•L-1(填“大于”、“小于”或“等于”).
(1)实验室配制1000mL0.50mol•L-1的Na2CO3溶液,在常用仪器中应选用1000mL的容量瓶,称量时若将法码放在左盘(1g以下用游码),则配制的溶液的物质的量浓度等于0.50mol•L-1(填“大于”、“小于”或“等于”).| 次数编号 | 待测盐酸体积(mL) | 滴入Na2CO3溶液体积(mL) |
| 1 | 20.00 | 18.80 |
| 2 | 20.00 | 16.95 |
| 3 | 20.00 | 17.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作、现象 | 结论 |
| A | 某溶液加入稀盐酸产生能使澄清石灰水变浑浊的无色无味气体;另取原溶液少许,向其中滴加CaCl2溶液,有白色沉淀生成 | 确定该溶液存在CO32- |
| B | 氯水中存在多种分子和离子,向新制氯水中加入有色布条,片刻后有色布条褪色 | 说明氯水中有HClO存在 |
| C | 将淀粉与KCl混合液装于半透膜内,浸泡在盛蒸馏水的烧杯中,5min后取烧杯中液体,加碘水变蓝色 | 证明半透膜有破损 |
| D | 将气体通入盛饱和碳酸钠溶液的洗气瓶 | 可用于除去中CO2的HCl |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C(Fe3+)=0.1mol/L的溶液中:NH4+、I-、SO42-、Cl- | |
| B. | 加入Al粉放出H2的溶液中:Na+、K+、Fe3+、NO3- | |
| C. | 0.1 mol•L-1AgNO3溶液:H+、K+、SO42-、Br- | |
| D. | pH=12的溶液中:K+、Cl-、CH3COO-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
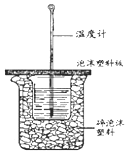 50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com