
A、氧的原子结构示意图: | ||
B、质量数为35的氯原子:
| ||
C、CH4分子的比例模型: | ||
D、次氯酸分子的电子式: |
 ,选项中为氧离子的结构示意图,故A错误;
,选项中为氧离子的结构示意图,故A错误; 为甲烷的球棍模型,甲烷的比例模型为:
为甲烷的球棍模型,甲烷的比例模型为: ,故C错误;
,故C错误; ,故D正确;
,故D正确;

 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
| A、次氯酸的结构式为:H-Cl-O |
B、-OH与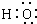 都表示羟基 都表示羟基 |
C、S2-的结构示意图:S2-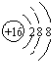 |
D、苯分子的球棍模型示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:
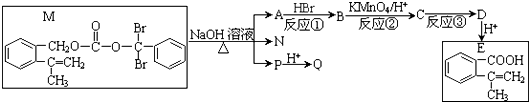
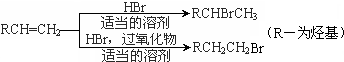 .请回答下列问题:
.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 在温度为373K时,将0.100mol无色的N2O4气体放入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O4?2NO2的平衡.如图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
在温度为373K时,将0.100mol无色的N2O4气体放入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O4?2NO2的平衡.如图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)| T/K | 323 | 373 |
| K值 | 0.022 | 0.36 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有羟基的化合物一定属于醇类 |
| B、含有苯环的物质一定属于芳香化合物 |
| C、含有环状碳链的有机物都是脂环化合物 |
| D、分子中只含碳碳单键的烃都是烷烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、MnO2 |
| B、H2S |
| C、NaHCO3 |
| D、稀HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| c(N2O4)/mol/L | 0.100 | c1 | 0.050 | c3 | c4 |
| c(NO2)/mol/L | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、② | B、②④⑤ |
| C、①③⑤ | D、②④⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com