分析:(1)①对于放热反应,升高温度,平衡常数减小;
②反应混合物各物质的量系数相同都为1,利用物质的量代替浓度,计算浓度商Qc,根据浓度商Qc与平衡常数k的关系判断.Qc>k平衡向逆反应进行,Qc=k反应处于平衡状态,Qc<k平衡向正反应进行;
③增大一种生产物(氢气)的体积分数,平衡向逆反应方向移动,平衡移动的结果是降低这种增大的幅度,故平衡后氢气的体积分数还是大于原来的;
(2)①根据方程式及表中数据计算c
2、c
1;
②由表可知,60s时反应达平衡,根据方程式计算△c(N
2O
4),依据化学反应速率V=
计算;
③依据化学平衡原理分析改变条件提高NO
2转化率的选项;
④依据平衡浓度计算平衡常数,结合化学平衡三段式列式计算,转化率=
×100%.
解答:
解:(1)①该反应是一个放热反应,升高温度,平衡常数减小,所以K<1,故答案为:小于;
②x=5时,此时的浓度商为:Q
c=
=1.67>1,浓度商大于平衡常数,则平衡向逆反应方向移动,故答案为:逆反应;
③加入6mol氢气所到达的平衡,可以等效为在加入5mol氢气到达平衡后再加入1mol氢气,增大一种生产物(氢气)的体积分数,平衡向逆反应方向移动,平衡移动的结果是降低这种增大的幅度,但平衡后氢气的体积分数还是大于原来的,故得H
2的体积分数分别为:a%<b%,即:a小于b,
故答案为:小于;
(2)①N
2O
4(g)?2NO
2(g)20s时c(NO
2)=0.060mol/L,
N
2O
4 ?2NO
2,
浓度变化 0.030mol 0.060mol/L,
则:c
1=0.10mol/L-0.03mol/L=0.070mol/L,
由表可知,40s时,c(N
2O
4)=0.050mol/L,
N
2O
4 ?2NO
2浓度变化:(0.1-0.05)mol/L 0.10mol/L
则:c
2=0.10mol/L,
所以:c
2>c
1;
故答案为:<;
②由表可知,60s时反应达平衡,c(NO
2)=0.120mol/L,
N
2O
4 ?2NO
2,
浓度变化:0.06mol/L 0.120mol/L
V(N
2O
4)=
=0.001mol/(L?s),
故答案为:0.001;
③N
2O
4=2 NO
2 反应是气体体积减小的放热反应,依据化学平衡原理分析选项,增大二氧化氮浓度的条件;
A.增大容器体积,各组分浓度均减小,故A错误;
B.再充入四氧化二氮,平衡正向移动,二氧化氮浓度增大,故B正确;
C.减小NO
2的浓度,平衡虽正向进行,但二氧化氮的浓度减小,故C错误;
D.再充入一定量的He,总压增大,气体分压不变,平衡不变,二氧化氮浓度不变,故D错误;
故答案为:B;
④依据平衡浓度计算平衡常数,结合化学平衡三段式列式计算;
N
2O
4?2NO
2,
起始量(mol/L) 0.10 0
变化量(mol/L) 0.06 0.12
平衡量(mol/L) 0.04 0.12
该温度下的平衡常数为:K=
=0.36
若起始时充入N0
2气体0.080mol,设消耗二氧化氮物质的量浓度为x,反应2NO
2=N
2O
4的平衡常数为K=
,
2 NO
2=N
2O
4起始量(mol/L) 0.0800 0
变化量(mol/L) x 0.5x
平衡量(mol/L) 0.080-x 0.5x
平衡常数为:K=
=
,
解得:x=0.020mol/L,
则达到平衡时N0
2气体的转化率为:
×100%=25%,
故答案为:25%.



 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案



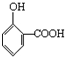 ,它与物质A的溶液反应生成化学式为C7H5O3Na的钠盐,A可以是下列中的( )
,它与物质A的溶液反应生成化学式为C7H5O3Na的钠盐,A可以是下列中的( )