
【题目】关于垃圾的处理正确的是
A. 果皮果核只能焚烧处理B. 旧塑料制品不必回收利用
C. 铝质易拉罐应回收利用D. 废旧衣服应该用堆肥法处理
 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.某有机物燃烧只生成CO2和H2O,且二者物质的量相等,则此有机物的组成为CnH2n
B.一种烃在足量的氧气中燃烧并通过碱石灰,减少的体积就是生成水蒸气的体积
C.某气态烃CxHy与足量O2恰好完全反应,如果反应前后气体体积不变(温度>100℃),则y=4,若体积减少,则y>4,否则y<4
D.相同质量的烃,完全燃烧,消耗的O2越多,则烃中氢元素的百分含量越高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属A、B和气体甲、乙、丙及物质C、D、F、F,它们之间的转化发生如下反应,(图中有些反应的产物和反应条件没有全部标出),黄绿色气体溶于水后的溶液有漂白性且能杀菌消毒,其中物质F的水溶液呈黄色,物质E在氧化剂作用下很容易转化为物质F,F能与物质C的溶液反应生成红褐色沉淀.
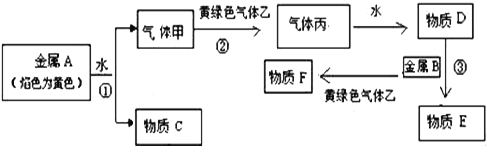
请回答下列问题:
(1)物质F的化学式为______.
(2)①写出金属A与水反应的化学方程式:______.
②写出黄绿色气体乙和水反应的离子化学方式:______.
③实验室制备黄绿色气体的化学方程式:___________.
(3)金属单质A投入到下列溶液中既有气体,又有沉淀出现的是______
A、氯化钠溶液 B、碳酸钠溶液 C、硫酸铜溶液 D、氯化铵溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】教材中制取氯气的方法如下:
(1)电解法制氯气:观察如图1,回答: 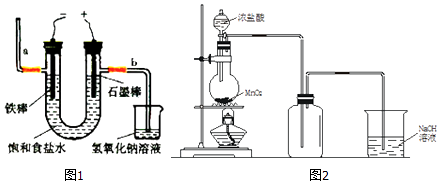
①此反应化学方程式为 .
②若饱和食盐水中含有酚酞,通电后(填“铁棒”或“石墨棒”)附近变红.图中b端产生的气体如用湿润的淀粉﹣KI试纸检验,其现象为 .
(2)实验室也可以用加热MnO2和浓盐酸制取Cl2 , 如图2
①盛装浓盐酸的仪器名称为;
②若要收集纯净且干燥的Cl2 , 此装置还应依次加入的试剂为;
③NaOH溶液的作用是 , 发生反应的化学方程式是;
④实验室用下列两种方法制氯气:I、用含HCl 146g的浓盐酸与足量的MnO2反应;
II、用87gMnO2与足量浓盐酸反应.所得的氯气
A. I比 II多 B. II比 I多 C.一样多 D.无法比较
⑤将Cl2溶于水得到新制的氯水,用玻璃棒蘸取新制的氯水,滴在pH试纸上,现象为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨的热化学方程式为N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJ/mol.现将1molN2(g)、3molH2(g)充入一容积为2L的密闭容器中,在500℃下进行反应,10min时达到平衡,NH3的体积分数为φ,下列说法中正确的是( ) 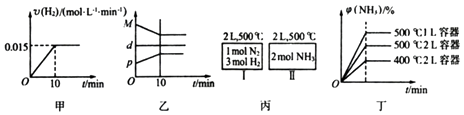
A.若达到平衡时,测得体系放出9.24kJ热量,则H2反应速率变化曲线如图甲所示
B.反应过程中,混合气体平均相对分子质量为M,混合气体密度为d,混合气体压强为p,三者关系如图乙
C.如图丙所示,容器I和II达到平衡时,NH3的体积分数为φ,则容器I放出热量与容器II吸收热量之和为92.4kJ
D.若起始加入物料为1 mol N2 , 3 mol H2 , 在不同条件下达到平衡时,NH3的体积分数变化如图丁所示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)按要求写出下列反应的化学方程式:
①由饱和FeCl3溶液制备Fe(OH)3胶体_______________________________。
②氢氟酸腐蚀玻璃____________________________________。
(2)按要求写出下列反应的离子方程式:
①制漂白粉(有效成分为次氯酸钙)____________________________________。
②用硫氰化钾溶液检验溶液中含有Fe3+____________________________________。
③向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性____________________________________。向以上中性溶液中继续滴加Ba(OH)2溶液,写出此步的离子方程式_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾(K2Cr2O7)主要用于制革、印染、电镀等.其水溶液中存在平衡:Cr2O72﹣+H2O2CrO42﹣+2H+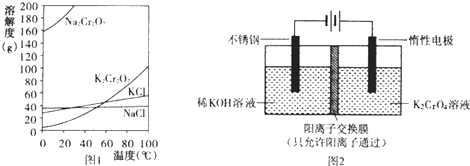
(1)已知有关物质溶解度如图1.用复分解法制备K2Cr2O7的操作过程是:向Na2Cr2O7溶液中加入(填化学式),搅拌溶解,调节溶液pH约为5,加热溶液至表面有少量晶体析出时, , 抽滤得到粗产品,再用重结晶法提纯粗产品.
(2)以铬酸钾(K2CrO4)为原料,用电化学法制备重铬酸钾的实验装置如图2.
①不锈钢作极,写出该电极的电极反应式 .
②分析阳极区能得到重铬酸钾溶液的原因 .
③当铬酸钾的转化率达到x时,阳极液中K与Cr的物质的量之比为
(3)铬对环境能造成污染.某酸性废水中含有Cr2O72﹣ , 处理时可用焦亚硫酸钠(Na2S2O5)将Cr2O72﹣转化为毒性较低的Cr3+ , 再调节pH约为8,使铬元素沉降,分离出污泥后检测废水中Cr3+浓度,低于0.5mgL﹣1则达到排放标准.
①Na2S2O5参加反应的离子方程式为 .
②经上述工艺处理后的废水,理论上Cr3+浓度约为 mgL﹣1 .
(已知室温下Ksp[Cr(OH)3]≈6×10﹣31)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①2C(s)+O2(g)═2CO(g)△H=﹣221.0kJmol﹣1;
②2H2(g)+O2(g)═2H2O(g)△H=﹣483.6kJmol﹣1 .
则制备水煤气的反应C(s)+H2O(g)═CO(g)+H2(g)的△H为( )
A.262.6 kJmol﹣1
B.﹣131.3 kJmol﹣1
C.﹣352.3 kJmol﹣1
D.131.3 kJmol﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com