
【题目】教材中制取氯气的方法如下:
(1)电解法制氯气:观察如图1,回答: 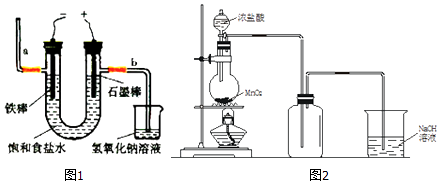
①此反应化学方程式为 .
②若饱和食盐水中含有酚酞,通电后(填“铁棒”或“石墨棒”)附近变红.图中b端产生的气体如用湿润的淀粉﹣KI试纸检验,其现象为 .
(2)实验室也可以用加热MnO2和浓盐酸制取Cl2 , 如图2
①盛装浓盐酸的仪器名称为;
②若要收集纯净且干燥的Cl2 , 此装置还应依次加入的试剂为;
③NaOH溶液的作用是 , 发生反应的化学方程式是;
④实验室用下列两种方法制氯气:I、用含HCl 146g的浓盐酸与足量的MnO2反应;
II、用87gMnO2与足量浓盐酸反应.所得的氯气
A. I比 II多 B. II比 I多 C.一样多 D.无法比较
⑤将Cl2溶于水得到新制的氯水,用玻璃棒蘸取新制的氯水,滴在pH试纸上,现象为 .
【答案】
(1)2NaCl+2H2O ![]() 2NaOH+Cl2↑+H2↑;铁棒;试纸变蓝
2NaOH+Cl2↑+H2↑;铁棒;试纸变蓝
(2)分液漏斗;饱和食盐水、浓硫酸;收集尾气;Cl2+2NaOH=NaCl+NaClO+H2O;B;试纸先变红后褪色
【解析】解:(1)电解法制氯气,是电解食盐水生成氢氧化钠、氢气、氯气,在电解池的阳极产生氯气,阴极产生氢气,同时有氢氧化钠产生,①电解反应的化学方程式为 2NaCl+2H2O ![]() 2NaOH+Cl2↑+H2↑,所以答案是:2NaCl+2H2O
2NaOH+Cl2↑+H2↑,所以答案是:2NaCl+2H2O ![]() 2NaOH+Cl2↑+H2↑;②电解食盐水时,铁做阴极,石墨棒做阳极,氢氧化钠在阴极即铁棒附近产生,所以通电后铁棒附近变红,图中b端产生氯气,检验氯气的方法是用湿润的淀粉碘化钾试纸检验,若变蓝则说明是氯气,所以答案是:铁棒;试纸变蓝;(2)①根据装置图,盛装浓盐酸的仪器名称为分液漏斗,所以答案是:分液漏斗;②浓盐酸易挥发,加热制备的氯气中含有氯化氢、水蒸气,氯气在饱和食盐水中溶解度不大,氯化氢易溶于水,选择饱和食盐水除去氯化氢,浓硫酸具有吸水性,可以干燥氯气;所以答案是:饱和食盐水、浓硫酸;③NaOH溶液的作用收集尾气,发生化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,所以答案是:收集尾气;Cl2+2NaOH=NaCl+NaClO+H2O;④反应化学方程式为MnO2+4HCl
2NaOH+Cl2↑+H2↑;②电解食盐水时,铁做阴极,石墨棒做阳极,氢氧化钠在阴极即铁棒附近产生,所以通电后铁棒附近变红,图中b端产生氯气,检验氯气的方法是用湿润的淀粉碘化钾试纸检验,若变蓝则说明是氯气,所以答案是:铁棒;试纸变蓝;(2)①根据装置图,盛装浓盐酸的仪器名称为分液漏斗,所以答案是:分液漏斗;②浓盐酸易挥发,加热制备的氯气中含有氯化氢、水蒸气,氯气在饱和食盐水中溶解度不大,氯化氢易溶于水,选择饱和食盐水除去氯化氢,浓硫酸具有吸水性,可以干燥氯气;所以答案是:饱和食盐水、浓硫酸;③NaOH溶液的作用收集尾气,发生化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,所以答案是:收集尾气;Cl2+2NaOH=NaCl+NaClO+H2O;④反应化学方程式为MnO2+4HCl ![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
理论计算:Ⅰ、含HCl146g的浓盐酸与足量的MnO2反应,4HCl~Cl2 , 可得氯气1mol,但随盐酸浓度变稀,溶质HCl不可能全部反应,故实际生成氯气应小于1mol;
Ⅱ、用87gMnO2与足量浓盐酸反应,因为浓盐酸足量,可以使87gMnO2全部反应,故生成氯气为1mol;所以II比 I多;
故选B;⑤氯气可与水反应生成盐酸和次氯酸,其中盐酸可使pH变成红色,次氯酸具有强氧化性,可漂白试纸,最后使试纸褪色.
所以答案是:试纸先变红后褪色.


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
【题目】下列试剂贮存方法错误的是( )
A. 浓硫酸密封保存
B. 氢氟酸保存在玻璃瓶中
C. 新制氯水保存在棕色试剂瓶中
D. 烧碱溶液可用带橡皮塞的玻璃瓶暂时保存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学按如图所示的装置进行电解实验.下列说法正确的是( ) 
A.电解过程中,铜电极上有H2产生
B.电解过程中,铜电极不断溶解
C.电解过程中,石墨电极上始终有铜析出
D.整个电解过程中,H+的浓度不断增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只可能含有下列离子中的几种:K+、NO![]() 、SO
、SO![]() 、NH
、NH![]() 、CO
、CO![]() (不考虑溶液中少量的H+和OH-),取200mL该溶液,分为两等份进行下列实验:
(不考虑溶液中少量的H+和OH-),取200mL该溶液,分为两等份进行下列实验:
实验1:第一份加入足量的烧碱并加热,产生的气体在标准状况下为224mL;
实验2:第二份先加入足量的盐酸,无现象,再加入足量的BaCl2溶液,得固体2.33g。
下列说法正确的是
A. 该溶液中可能含K+
B. 该溶液中肯定含有NO![]() 、SO
、SO![]() 、NH
、NH![]() 、CO
、CO![]()
C. 该溶液中一定不含NO![]()
D. 该溶液中一定含K+,且c(K+)≥0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)N原子的结构示意图为
(2)含有相同氧原子数的NO和NO2 , 物质的量比为 , 质量比为 , 电子数目比为
(3)在①漂白粉 ②MgCl2③食盐水 ④氯气 ⑤铁 ⑥Na2O ⑦稀硫酸 ⑧CO2 ⑨液氨 ⑩酒精 中属于电解质的是(填选项,下同),属于非电解质的是
A.①②B.②⑥C.②③⑥D.⑧⑨⑩E.⑧⑨F.④⑧⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、Cl﹣、NH4+、Mg2+、CO32﹣、Ba2+、SO42﹣ . 将该混合物溶于水后得澄清溶液,现取3份100mL该溶液分别进行如下实验:
实验序号 | 实验内容 | 实验结果 |
1 | 加AgNO3溶液 | 有白色沉淀生成 |
2 | 加足量NaOH溶液并加热 | 收集到气体1.12L(已折算成标准状况下的体积) |
3 | 加足量BaCl2溶液,反应后进行( )、( )、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量读数为6.27g,第二次称量读数为2.33g |
试回答下列问题:
(1)根据实验1~3判断混合物中一定不存在的离子是;
(2)写出实验3中的空格处的实验操作;
(3)根据实验对Cl﹣是否存在的判断是(填“一定存在”、“一定不存在”或“不能确定”);
(4)溶液中K+是否存在?(填“一定存在”、“一定不存在”或“不能确定”);若“一定存在”,则K+物质的量浓度的范围(若“一定不存在”或“不能确定”不填此空).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙苯催化脱氢生产苯乙烯的反应:![]()
(1)一定温度下,将amol乙苯加入体积为VL的密闭容器中,发生上述反应,反应时间与容器内气体总压强的数据如下表.
时间/min | 0 | 10 | 20 | 30 | 40 |
总压强/1000kPa | 1.0 | 1.2 | 1.3 | 1.4 | 1.4 |
①平衡时,容器中气体物质的量总和为 mol,乙苯的转化率为
②列式计算此温度下该反应的平衡常数K
(2)根据化学反应原理,分析减小压强对该反应的影响
(3)实际生产的反应在常压下进行,且向乙苯蒸气中掺入水蒸气,利用热力学数据计算得到温度和投料比对乙苯转化率的影响可用图表示.[M=n(H2O)/n(乙苯]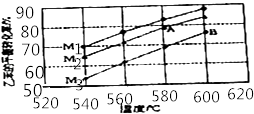
比较图中A,B两点对应平衡常数大小:KAKB
②图中投料比(M1、M2、M3)的大小顺序为
③随着反应的进行,催化剂上的少量积炭使其活性减弱,水蒸气有助于恢复催化剂的活性,原因是(用化学方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国古代四大发明之一﹣﹣黑火药,它的爆炸反应为:2KNO3+3C+S ![]() A+N2↑+3CO2↑(已配平)
A+N2↑+3CO2↑(已配平)
①除S外,上列元素的电负性从大到小依次为 . 除K、S外第一电离能从大到小的顺序为 .
②在生成物中,A的晶体类型为 , 含极性共价键的分子的中心原子轨道杂化类型为 .
③CN﹣与N2互为 , 推算HCN分子中σ键与π键数目之比 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com