
【题目】按要求填空
(1)N原子的结构示意图为
(2)含有相同氧原子数的NO和NO2 , 物质的量比为 , 质量比为 , 电子数目比为
(3)在①漂白粉 ②MgCl2③食盐水 ④氯气 ⑤铁 ⑥Na2O ⑦稀硫酸 ⑧CO2 ⑨液氨 ⑩酒精 中属于电解质的是(填选项,下同),属于非电解质的是
A.①②B.②⑥C.②③⑥D.⑧⑨⑩E.⑧⑨F.④⑧⑩
【答案】
(1)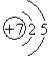
(2)2:1;30:23;30:23
(3)B;D
【解析】解:(1)N原子的核电荷数、核外电子总数都是7,其原子结构示意图为: 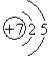 ,所以答案是:
,所以答案是: 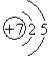 ;(2)NO和NO2分子分别含有1个O原子、2个O原子,含有相同氧原子数的NO和NO2 , 二者物质的量比为2:1,二者质量之比=2mol×30g/mol:1mol×46g/mol=30:23;二者含有电子数之比=含有电子的物质的量之比=(15×2):(23×1)=30::23,所以答案是:2:1; 30:23;30:23;(3)根据电解质的定义,在水溶液中或熔化状态上能导电的化合物称为电解质,在上述两种情况下都不能导电的化合物称为非电解质,所以在上述物质中属于电解质的是②⑥,即B正确;属于非电解质的是⑧⑨⑩,即D正确,
;(2)NO和NO2分子分别含有1个O原子、2个O原子,含有相同氧原子数的NO和NO2 , 二者物质的量比为2:1,二者质量之比=2mol×30g/mol:1mol×46g/mol=30:23;二者含有电子数之比=含有电子的物质的量之比=(15×2):(23×1)=30::23,所以答案是:2:1; 30:23;30:23;(3)根据电解质的定义,在水溶液中或熔化状态上能导电的化合物称为电解质,在上述两种情况下都不能导电的化合物称为非电解质,所以在上述物质中属于电解质的是②⑥,即B正确;属于非电解质的是⑧⑨⑩,即D正确,
所以答案是:B;D.


科目:高中化学 来源: 题型:
【题目】实验室需要 0.2mol/L的硫酸铜溶液480ml,现用胆矾晶体来配制该溶液,回答下列问题
(1)实验中用到的玻璃仪器有量筒、玻璃棒、烧杯、托盘天平,还缺少(填仪器名称)
(2)应称量胆矾晶体的质量 .
(3)下列操作会使所配溶液浓度偏低的是 .
①胆矾失去了部分结晶水②容量瓶未干燥就使用③称量晶体时所用的砝码已经生锈④定容时俯视刻度线⑤定容摇匀后发现液面低于刻度线,又加水至刻度线
(4)下列操作中,容量瓶所不具备的功能有(填序号).
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.用来加热溶解固体溶质
(5)若实验室想要将密度为1.84g/cm3、质量分数为98%的浓硫酸稀释成1000ml、物质的量浓度为2mol/L、密度为1.20g/cm3的稀硫酸,则所需浓硫酸的体积 , 所需水的体积 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上从海水中提取溴的主要反应是:C12+2Br-=2Cl-+Br2 。下列说法错误的是
A. 海水中溴元素主要以形式Br-存在B. 上述反应属于离子反应
C. 该反应中氧化剂是Br-D. 上述反应属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属A、B和气体甲、乙、丙及物质C、D、F、F,它们之间的转化发生如下反应,(图中有些反应的产物和反应条件没有全部标出),黄绿色气体溶于水后的溶液有漂白性且能杀菌消毒,其中物质F的水溶液呈黄色,物质E在氧化剂作用下很容易转化为物质F,F能与物质C的溶液反应生成红褐色沉淀.
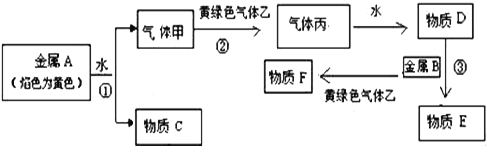
请回答下列问题:
(1)物质F的化学式为______.
(2)①写出金属A与水反应的化学方程式:______.
②写出黄绿色气体乙和水反应的离子化学方式:______.
③实验室制备黄绿色气体的化学方程式:___________.
(3)金属单质A投入到下列溶液中既有气体,又有沉淀出现的是______
A、氯化钠溶液 B、碳酸钠溶液 C、硫酸铜溶液 D、氯化铵溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】教材中制取氯气的方法如下:
(1)电解法制氯气:观察如图1,回答: 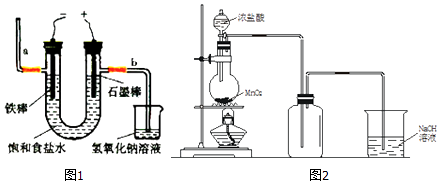
①此反应化学方程式为 .
②若饱和食盐水中含有酚酞,通电后(填“铁棒”或“石墨棒”)附近变红.图中b端产生的气体如用湿润的淀粉﹣KI试纸检验,其现象为 .
(2)实验室也可以用加热MnO2和浓盐酸制取Cl2 , 如图2
①盛装浓盐酸的仪器名称为;
②若要收集纯净且干燥的Cl2 , 此装置还应依次加入的试剂为;
③NaOH溶液的作用是 , 发生反应的化学方程式是;
④实验室用下列两种方法制氯气:I、用含HCl 146g的浓盐酸与足量的MnO2反应;
II、用87gMnO2与足量浓盐酸反应.所得的氯气
A. I比 II多 B. II比 I多 C.一样多 D.无法比较
⑤将Cl2溶于水得到新制的氯水,用玻璃棒蘸取新制的氯水,滴在pH试纸上,现象为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨的热化学方程式为N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJ/mol.现将1molN2(g)、3molH2(g)充入一容积为2L的密闭容器中,在500℃下进行反应,10min时达到平衡,NH3的体积分数为φ,下列说法中正确的是( ) 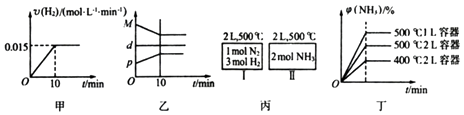
A.若达到平衡时,测得体系放出9.24kJ热量,则H2反应速率变化曲线如图甲所示
B.反应过程中,混合气体平均相对分子质量为M,混合气体密度为d,混合气体压强为p,三者关系如图乙
C.如图丙所示,容器I和II达到平衡时,NH3的体积分数为φ,则容器I放出热量与容器II吸收热量之和为92.4kJ
D.若起始加入物料为1 mol N2 , 3 mol H2 , 在不同条件下达到平衡时,NH3的体积分数变化如图丁所示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾(K2Cr2O7)主要用于制革、印染、电镀等.其水溶液中存在平衡:Cr2O72﹣+H2O2CrO42﹣+2H+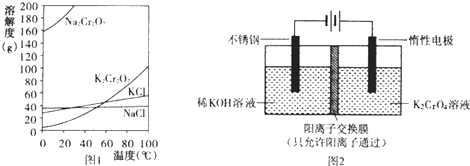
(1)已知有关物质溶解度如图1.用复分解法制备K2Cr2O7的操作过程是:向Na2Cr2O7溶液中加入(填化学式),搅拌溶解,调节溶液pH约为5,加热溶液至表面有少量晶体析出时, , 抽滤得到粗产品,再用重结晶法提纯粗产品.
(2)以铬酸钾(K2CrO4)为原料,用电化学法制备重铬酸钾的实验装置如图2.
①不锈钢作极,写出该电极的电极反应式 .
②分析阳极区能得到重铬酸钾溶液的原因 .
③当铬酸钾的转化率达到x时,阳极液中K与Cr的物质的量之比为
(3)铬对环境能造成污染.某酸性废水中含有Cr2O72﹣ , 处理时可用焦亚硫酸钠(Na2S2O5)将Cr2O72﹣转化为毒性较低的Cr3+ , 再调节pH约为8,使铬元素沉降,分离出污泥后检测废水中Cr3+浓度,低于0.5mgL﹣1则达到排放标准.
①Na2S2O5参加反应的离子方程式为 .
②经上述工艺处理后的废水,理论上Cr3+浓度约为 mgL﹣1 .
(已知室温下Ksp[Cr(OH)3]≈6×10﹣31)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 医用酒精的浓度通常是95%
B. 蛋白质是结构复杂的高分子化合物,分子中都含有C、H、O、N四种元素
C. 淀粉、纤维素和油脂都属于天然高分子化合物
D. 合成纤维和光导纤维都是新型无机非金属材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com