
����Ŀ�����б�ʾ��Ӧ��ѧ��Ӧ�����ӷ���ʽ��ȷ����
A. ��NaNO2����������Һ�е�KI��2I�� + NO2��+ 2H+ = I2 + NO��+ H2O
B. ��NH4HCO3��Һ�мӹ�����NaOH��Һ�����ȣ�NH4+ + OH�� ![]() NH3 ��+ H2O
NH3 ��+ H2O
C. ������SO2ͨ���䰱ˮ�У�SO2 + NH3��H2O = HSO3- + NH4+
D. ��ϡ����ϴ���Թ��ڱڵ�������Ag + 4H+ + NO3��= Ag+ + NO��+ 2H2O
���𰸡�C
��������
A����NaNO2����������Һ�еĵ⻯�أ�����I2��NO����ȷ�����ӷ�ӦΪ��2I- +2 NO2-+ 4H+ = I2 + 2NO��+ 2H2O����A����
B����NH4HCO3��Һ�мӹ�����NaOH��Һ�����ȣ�̼���������������Ӷ���ȫ��Ӧ����ȷ�����ӷ���ʽΪ��HCO3-+NH4++2OH-![]() NH3��+CO32-+2H2O����B����
NH3��+CO32-+2H2O����B����
C��������SO2ͨ���䰱ˮ�У���Ӧ������������泥���Ӧ�����ӷ���ʽΪ��SO2+NH3H2O=HSO3-+NH4+����C��ȷ��
D����ϡ����ϴ���Թ��ڱڵ����������ӷ���ʽΪ��3Ag+4H++NO3-=3Ag++NO��+2H2O����D����
�ʴ�ΪC��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ�Ǿ����Դ���⣺�Ӻ�ˮ����ȡʳ�κ���Ĺ������£�
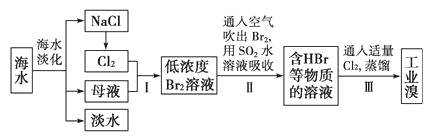
����˵���������
A.��ˮ�����ķ�����Ҫ�������������������ӽ�������
B.������ڵ��Ȼ�����һ��������ת��Ϊ��ѧ�ܵĹ���
C.������н�Br2��ԭΪBr����Ŀ���Ǹ�����Ԫ��
D.��ĸҺ�м���ʯ����ɵõ�Mg(OH)2����ҵ�ϳ��õ�����ڵ�Mg(OH)2����ȡþ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������H��һ��ҽҩ�м��壬�����ڷ�ɹ˪�������ߵ����ռ���ʵ�����ɻ�����A��E�Ʊ�H��һ�ֺϳ�·������ͼ:
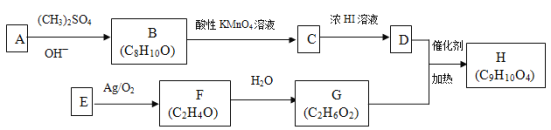
��֪��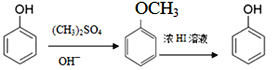
��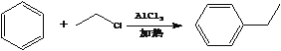
�ش���������:
(1)���ⶨE����Է�������Ϊ28���������ⶨ�л�����Է�������������Ϊ_______��F��ֻ��һ�ֻ�ѧ��������ԭ�ӣ���ṹ��ʽΪ_________________��
(2)(CH3)2SO4��һ������������Ϊ_________________��
(3)A����Na2CO3��Һ��Ũ��ˮ��Ӧ����1molA������2molBr2��Ӧ���˴Ź������ױ���A�ı����������ֲ�ͬ��ѧ��������ԭ�ӡ�A�Ľṹ��ʽΪ______________��C�к��������ŵ�����Ϊ_________��
(4)D+G��H�Ļ�ѧ����ʽΪ__________________��
(5)C��ͬ���칹������ͬʱ�������������Ĺ���_____��(���������칹)��
����FeCl3��Һ������ɫ��Ӧ
���ܷ���ˮ�ⷴӦ
(6)���������ϳ�·�ߣ����һ����![]() ��(CH3)3CClΪ��ʼԭ���Ʊ�
��(CH3)3CClΪ��ʼԭ���Ʊ�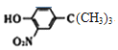 �ĺϳ�·��(�����Լ���ѡ)�� ________________________________________��
�ĺϳ�·��(�����Լ���ѡ)�� ________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Z��һ��ҽҩ�м��壬��X�Ʊ�Z������ת��·����ͼ������˵����ȷ���ǣ� ��
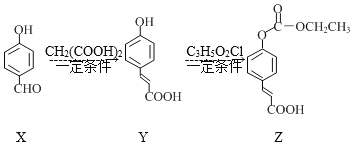
A.X�ڿ����в�����������
B.����FeCl3��Һ����X��Y
C.1molX�������4molH2��Ӧ
D.C3H5O2Cl�Ľṹ��ʽΪClCOOC2H5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���װ�Ǧ��(CH3NH3PbI3)������ȫ��̬���ѿ�����̫���ܵ�ص�����������CH3NH2��PbI2��HIΪԭ�Ϻϳɣ��ش��������⣺
(1)��ȡ�װ��ķ�ӦΪCH3OH(g)��NH3(g)![]() CH3NH2(g)��H2O(g)����H����֪�÷�Ӧ����ػ�ѧ���ļ����������£�
CH3NH2(g)��H2O(g)����H����֪�÷�Ӧ����ػ�ѧ���ļ����������£�
���ۼ� | C��O | H��O | N��H | C��N |
����/(kJ/mol) | 351.5 | 463 | 393 | 293 |
��÷�Ӧ����H��________kJ/mol��
(2)������Ӧ������ļ״���ҵ������ˮú���ϳɣ���ӦΪCO(g)��2H2(g) ![]() CH3OH(g) ��H<0����һ�������£���1 mol CO��2 mol H2ͨ���ܱ������н��з�Ӧ�����ı�ijһ�������(�¶Ȼ�ѹǿ)ʱ��CH3OH�����������(CH3OH)�仯������ͼ��ʾ��
CH3OH(g) ��H<0����һ�������£���1 mol CO��2 mol H2ͨ���ܱ������н��з�Ӧ�����ı�ijһ�������(�¶Ȼ�ѹǿ)ʱ��CH3OH�����������(CH3OH)�仯������ͼ��ʾ��

������˵�������жϸ÷�Ӧ�ﵽ��ѧƽ��״̬����________��
A.��ϵ��������ܶȱ��ֲ���
B.CO������������CH3OH�������������
C.��ϵ��CO��ת���ʺ�H2��ת�������
D.��ϵ��CH3OH������������ֲ���
��ƽ��ʱ��M��CH3OH���������Ϊ10%����CO��ת����Ϊ________��
��ijͬѧ��Ϊ��ͼ��Y���ʾ�¶ȣ�����Ϊ���жϵ�������______________________��
(3)ʵ���ҿ�����������Ǧ������ᷴӦ�Ʊ����ܵ�PbI2��ͬʱ����I2��д�������Ļ�ѧ��Ӧ����ʽ__________________��
(4)HI���Ʊ�����0.8molI2(g)��1.2molH2(g)����ij1L�ܱ������У���һ���¶��·�����Ӧ��I2(g)+H2(g)![]() 2HI(g)���ﵽƽ�⡣HI�����������ʱ��ı仯�������ʾ��
2HI(g)���ﵽƽ�⡣HI�����������ʱ��ı仯�������ʾ��
ʱ��(min) | 1 | 2 | 3 | 4 | 5 | 6 | 7/span> |
HI������� | 26% | 42% | 52% | 57% | 60% | 60% | 60% |
�ٸ÷�Ӧ��ƽ�ⳣ��K=_____________��
�ڷ�Ӧ�ﵽƽ�����7minʱ���������ѹ��Ϊԭ����һ�룬����ͼ�л���c(HI)��ʱ��仯������_______________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���շ���͡��һ�ֵ���Ѫ֬��ҩ���ṹ��ʽ��ͼ��ʾ�����й����շ���͡��������ȷ����

A. ����FeCl3��Һ������ɫ��ӦB. ������������ˮ
C. �ܷ����ӳɡ�ȡ������ȥ��ӦD. 1mol ������������1mol NaOH��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��250Cʱ����c(CH3COOH)+c(CH3COO��)=0.1mol��L-1��һ����ᡢ�����ƻ����Һ����Һ��c(CH3COOH)��c(CH3COO��)��pH �Ĺ�ϵ��ͼ7 ��ʾ�������й���Һ������Ũ�ȹ�ϵ��������ȷ����

A. pH="5." 5 ����Һ�У� c(CH3COOH)>c(CH3COO��)>c(H��)>c(OH��)
B. W ������ʾ����Һ�У� c(Na��)+c(H��)= c(CH3COOH)+c(OH��)
C. pH =" 3." 5 ����Һ�У� c(Na��) +c(H��) -c(OH��) +c(CH3COOH)=0.1mol��L-1
D. ��W ������ʾ��1.0L ��Һ��ͨ��0.05mol HCl ����(��Һ����仯�ɺ���)�� c(H��)= c(CH3COOH)+c(OH��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO2��һ�����۵�̼��Դ�����ۺ����þ�����Ҫ���塣
��һ��CO2�Ļ�ѧ����
��1��CO2���Ա�NaOH��Һ������������ҺpH=13��CO2��Ҫת��Ϊ___��д��̼���ӷ��ţ����������£�H2CO3��Ka1=4.3��10��7��Ka2=5.6��10��11��
��2��������������أ�SOEC�����ڸ��¹����CO/H2���ȿ�ʵ��CO2�ļ����ֿɸ�Ч�Ʊ��ϳ�����CO/H2�����乤��ԭ����ͼ��д���缫A�����ĵ缫��Ӧʽ___��

������CO2���ۺ�����
��1��CO2��CH4���������Ƶúϳ�����
��Ӧ��CH4��g��H+CO2��g��2CO��g��+2H2��g����H1
��֪������һ����̼�ͼ���ı�ȼ���ȣ�25�棩�����ʾ
���� | H2��g�� | CO��g�� | CH4��g�� |
��ȼ���ȡ�H/kJmol��1 | ��285.8 | ��283.0 | ��890.3 |
��ӦI�ġ�H=___kJmol��1��
��2����CO2��������ȡ�����ѵķ�ӦΪ����Ӧ��.2CO2��g��+6H2��g��CH3OCH3��g��+3H2O��g������10L�����ܱ������У�������2mol CO2��6moH2���ֱ���ҿ��Ir�����棨Ce������������Ӧ������ͬ��ʱ����õ�CO2��ת��������CO2���淴Ӧ�¶ȵı仯�����ͼ1��
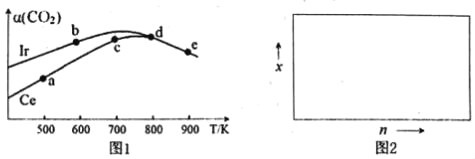
�ٸ���ͼ1������˵������ȷ����___��
A����Ӧ��ġ�H��0����S��0
B����Ir��Ce������ʱ����Ӧ��Ļ�ܸ��͵���Ce
C��״̬dʱ��v��������v���棩
D����״̬b��d������CO2����������С����С��ԭ��������¶�����ƽ�������ƶ�
��״̬e��900K��ʱ������CO2��=50%�����ʱ��ƽ�ⳣ��K=___��
����H2��CO2�����ʵ���֮��Ϊn��1��900Kʱ��Ӧƽ����ϵ�ж����ѵ����ʵ�������Ϊx������ͼ2�л���x��n�仯��ʾ��ͼ��_______
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
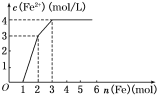
����Ŀ��ijϡ��Һ�к���Fe(NO3)3��Cu(NO3)2��HNO3�����������������ۣ���Һ��Fe2��Ũ�Ⱥͼ������۵����ʵ���֮��Ĺ�ϵ��ͼ��ʾ����ϡ��Һ��Fe(NO3)3��Cu(NO3)2��HNO3���ʵ���Ũ��֮��Ϊ____������Ӧ���Ⱥ�˳��д���ù��̵����ӷ�Ӧ����ʽ��___________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com