
分析 氯水中的氯气氧化性大于溴单质,可以优惠溴离子生成溴单质,利用单质溴在水中和其他溶剂中溶解度的不同提纯溴,为萃取,常用仪器为分液漏斗,萃取剂一般为四氯化碳、苯等有机溶剂,溴单质被四氯化碳萃取溶液显橙红色;
解答 解:将适量新制氯水加人20mL富含溴离子的海水中(海水可以用0.1mol•L-1、的NaBr溶液代替),把溴置换出来,反应的离子方程式为:Cl2+2Br-=Br2+2Cl-,反应中氯元素化合价0价变化为-1价做氧化剂,得到溴单质可以用有机溶剂四氯化碳或苯在分液漏斗中萃取分液分离,溴单质被四氯化碳萃取溶液显橙红色,
故答案为:氧化;Cl2+2Br-=Br2+2Cl-;分液漏斗;CCl4;橙红色;
点评 本题考查了海水提溴的原理和提取实验基本操作,主要是仪器和试剂的选择,掌握基础是解题关键,题目较简单.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题

| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 35 | 50 | 60 | 70 | 80 |
| 温度/℃ | 25 | 26 | 26 | 26 | 26 | 26 | 26.5 | 27 | 27 | 27 | 27 |
| 操作 | 现象 |
| 向该绿色溶液中通入氮气(或向硝酸铜溶液中通入浓硝酸与铜反应产生的气体) | 溶液颜色变蓝(或绿色加深) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 石油液化气、汽油和石蜡的主要成分都是碳氢化合物 | |
| B. | CH3-CH=CH-CH3与C3H6一定互为同系物 | |
| C. | 用浸泡过高锰酸钾溶液的硅藻土吸收水果释放的乙烯,可达到水果保鲜的目的 | |
| D. | 等质量的乙烯和聚乙烯充分燃烧所需氧气的量不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8种 | B. | 9种 | C. | 10种 | D. | 11种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
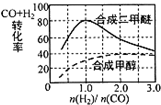 碳和碳的化合物在生产、生活中有重要作用,甲醇水蒸气重整制氢系统可能发生下列三个反应:
碳和碳的化合物在生产、生活中有重要作用,甲醇水蒸气重整制氢系统可能发生下列三个反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
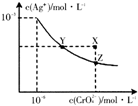 已知t℃时,AgCl的Ksp=2×10-10,Ag2CrO4(橙红色固体)在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是( )
已知t℃时,AgCl的Ksp=2×10-10,Ag2CrO4(橙红色固体)在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是( )| A. | t℃时,AgCl在水中的溶解度比在稀盐酸中小 | |
| B. | t℃时,AgCl的溶解度大于Ag2CrO4 | |
| C. | 在饱和Ag2CrO4溶液中加入少量K2CrO4,可使溶液由Y点移至X点 | |
| D. | 向同浓度NaCl和K2CrO4混合液中,滴加0.1mol•L-1AgNO3溶液,先生成白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 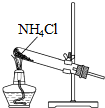 制取氨气 | B. | 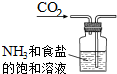 制取NaHCO3 | C. | 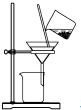 分离NaHCO3 | D. | 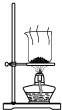 干燥NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤⑥ | B. | ②③④⑤⑥ | C. | ②⑤⑥ | D. | ①②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | 只有⑤ | C. | ③④⑤ | D. | 只有①②③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com