
 碳和碳的化合物在生产、生活中有重要作用,甲醇水蒸气重整制氢系统可能发生下列三个反应:
碳和碳的化合物在生产、生活中有重要作用,甲醇水蒸气重整制氢系统可能发生下列三个反应:分析 (1)依据热化学方程式和盖斯定律计算得到所需热化学方程式的焓变;
(2)CH3OH(g)+H2O(g)?CO2(g)+3H2(g)△H2=+49kJ/mol,反应是气体体积增大的吸热反应,升温增大反应速率平衡正向进行;
(3)①将Co2+氧化为Co3+,电极上发生失电子的氧化反应;
②Co3+将甲醇氧化为二氧化碳,本身被还原为Co,电解质环境是酸性的,根据电子守恒配平方程式即可;
(4)①依据化学方程式定量关系分析按照化学方程式中定量关系是恰好反应的最佳比;
②3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g),反应的平衡常数KP表达式为生成物平衡分压幂次方乘积除以反应物平衡分压幂次方乘积;
(5)依据燃烧热的定义可写出相应的热化学方程式,再利用盖斯定律计算得到所需热化学方程式.
解答 解:(1)CH3OH(g)?CO(g)+2H2(g)△H2=+90.8kJ/mol
②CH3OH(g)+H2O(g)?CO2(g)+3H2(g)△H2=+49kJ/mol
依据盖斯定律计算②-①得到③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.8 kJ/mol,
故答案为:-41.8 kJ/mol;
(2)CH3OH(g)+H2O(g)?CO2(g)+3H2(g)△H2=+49kJ/mol,反应是气体体积增大的吸热反应,升高温度反应速率加快,升高温度有利于反应②向正反应方向移动,
故答案为:反应速率加快,有利于向正反应方向移动;
(3)①其原理是电解CoSO4、稀硫酸和CH3OH的混合溶液,将Co2+氧化为Co3+,Co3+再将CH3OH氧化成CO2.
电解池中该电极上发生失电子的氧化反应,电极反应为:Co2+-e-═Co3+,
故答案为:Co2+-e-═Co3+;
②Co3+将甲醇氧化为二氧化碳,本身被还原为Co,即6Co3++CH3OH+H2O═CO2↑+6Co2++6H+,故答案为:6Co3++CH3OH+H2O═CO2↑+6Co2++6 H+;
(3)①Co2+-e-═Co3+;
②6 Co3++CH3OH+H2O═CO2↑+6 Co2++6 H+(2分)
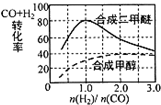
(4)①3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g),图象分析可知在相同条件下合成二甲醚和合成甲醇的原料平衡转化率随氢碳比1:1,
故答案为:1:1;
②3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g),反应的平衡常数KP表达式为生成物平衡分压幂次方乘积除以反应物平衡分压幂次方乘积$\frac{p(C{H}_{3}OC{H}_{3})p(C{O}_{2})}{{p}^{3}({H}_{2}){p}^{3}(CO)}$,
故答案为:$\frac{p(C{H}_{3}OC{H}_{3})p(C{O}_{2})}{{p}^{3}({H}_{2}){p}^{3}(CO)}$;
(5)石墨和一氧化碳的燃烧热△H分别为-393.5kJ/mol和-283.0kJ/mol,的燃烧热的热化学方程式为
①C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
②CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ•mol-1
依据盖斯定律计算①-②,得到C(s)+$\frac{1}{2}$O2(g)═CO(g)△H0=-110.5 kJ/mol,
CO(g)的△H0为-110.5 kJ/mol,
故答案为:-110.5 kJ/mol.
点评 本题考查了热化学方程式书写、电解池原理分析和电极反应书写、主要是反应生成焓的计算,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L臭氧与22.4L氢气所含原子数均为2NA | |
| B. | 46gNO2和N2O4的混合气体中含有的原子数为3NA | |
| C. | 2.24LCH4所含电子数为NA | |
| D. | 1molO2参加反应转移的电子数一定为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
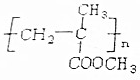 ,此物质与氢氧化钠共热后加入盐酸,能得到两种有机产物,下列物质与产物之一互为同分异构体( )
,此物质与氢氧化钠共热后加入盐酸,能得到两种有机产物,下列物质与产物之一互为同分异构体( )| A. | 丁酸 | B. | CH2=CHCH2COOH | C. | 甲酸丙酯 | D. | 丙烯酸甲酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ③④ | C. | ①③ | D. | ①④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com