
能正确表示下列反应的离子方程式为
A.硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S?
B.NH4HCO3溶于过量的NaOH溶液中:HCO3?+OH?=CO32?+H2O
C.少量SO2通入苯酚钠溶液中:C6H5O?+SO2+H2O=C6H5OH+HSO3?
D.大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO?+CO2↑+H2O
科目:高中化学 来源:2015-2016学年江西省高二上二次月考化学试卷(解析版) 题型:选择题
在一密闭容器中,反应aA(气) bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
A.平衡向逆反应方向移动了 B.物质B的质量分数增加了
C. 物质A的转化率减少了 D.a>b
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三上第四次段考化学试卷(解析版) 题型:推断题
X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大。元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X-半径,Y的氧化物是形成酸雨的主要物质之一。
请回答:
(1)Q元素在周期表中的位置
(2)将这五种元素原子半径从大到小排列,排在第三的元素原子是 (填元素符号)
(3)元素的非金属性Z Q(填“>”或“<”),下列各项中,不能说明这一结论的事实有 (填序号)
A.Q的氢化物的水溶液放置在空气中会变浑浊
B.Z与Q之间形成的化合物中元素的化合价
C.Z和Q的单质的状态
D.Z和Q在周期表中的位置
(4) X与Y可形成分子A,也可形成阳离子B,A、B在水溶液中酸、碱性恰好相反,写出A的电子式 ;B的水溶液不呈中性的原因 (用离子方程式表示)
(5) 液态A类似X2Z能微弱电离且产生电子数相同的两种离子,则液态A的电离方程式为
(6)若使A按下列途径完全转化为F:
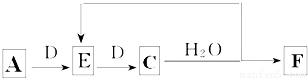
①F的化学式为 ;
②参加反应的A与完全转化为F时整个过程中消耗D的物质的量之比为
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期期中考试化学试卷(解析版) 题型:实验题
锌是一种常用金属,冶炼方法有火法和湿法。
I.镓(Ga)是火法冶炼锌过程中的副产品,镓与铝同主族且相邻,化学性质与铝相似.氮化镓(GaN)是制造LED的重要材料,被誉为第三代半导体材料。
(1)Ga在元素周期表中的位置________________________。
(2)GaN可由Ga和NH3在高温条件下合成,该反应的化学方程式为______________________。
(3) 下列有关镓和镓的化合物的说法正确的是_______________(填字母序号)。
A.一定条件下,Ga可溶于盐酸和氢氧化钠
B.常温下,Ga可与水剧烈反应放出氢气
C.Ga2O3可由Ga(OH)3受热分解得到
D.一定条件下,Ga2O3可与NaOH反应生成盐
II.工业上利用锌焙砂(主要含Zn0、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物)湿法制取金属锌的流程如图所示,回答下列问题:
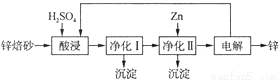
已知:Fe的活泼性强于Ni
(4)ZnFe2O4可以写成ZnO•Fe2O3,写出ZnFe2O4与H2SO4反应的化学方程式 ______________________。
(5)净化I操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,只使Fe3+转化为Fe(OH)3沉淀.净化I生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是_______________。
(6)净化II中加入Zn的目的是______________________。
Ⅲ.(7)某化学课外小组拟用废旧电池锌皮(含杂质铁),结合下图信息从提供的试剂中选取适当试剂,制取纯净的ZnSO4•7H2O.
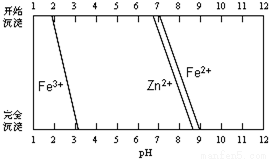
实验步骤如下:
①将锌片完全溶于稍过量的3mol•L-1稀硫酸,加入_______(选填字母,下同);
A.30%H2O2 B.新制氯水 C.FeCl3溶液 D.KSCN溶液
②加入__________;
A.纯锌粉 B.纯碳酸钙粉末 C.纯ZnO粉末 D.3mol•L-1稀硫酸
③加热到60℃左右并不断搅拌;
④趁热过滤得ZnSO4溶液,再蒸发浓缩、冷却结晶,过滤、洗涤、干燥.
其中步骤③加热的主要目的是__________________________。
查看答案和解析>>
科目:高中化学 来源:2016届安徽马鞍山、淮北、铜陵四校高三上第三次联考化学试卷(解析版) 题型:填空题
【化学—选修3:物质结构与性质】
绿柱石被国际珠宝界公认为四大名贵宝石之一。主要成分为Be3Al2[Si6O18],因含适量的Cr2O3(0.15~0.6%),而形成祖母绿。试回答下列问题:
(1)基态Al原子中,电子填充的最高能级是_______,基态Cr原子的价电子排布式是_____。
(2)用“>”或“<”填空:
第一电离能 | 键能 | 沸点 | 离子半径 |
Be_____B | C—C_____Si—Si | H2S_____H2O | Al3+_____O2- |
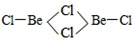
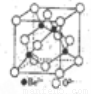
(3)BeCl2分子的空间构型是______,它的二聚体Be2Cl4结构如右图所示,其中Be原子的杂化方式是_____。
(4)强还原剂LiAlH4能将SiCl4还原成SiH4,试写出SiH4在空气中自燃的化学方程式______。
(5)Be的氧化物的立方晶胞结构如右图所示,已知氧化铍晶体的密度为ρg·cm-3,则晶胞连长为___cm(设NA为阿伏加德罗常数的值,用含NA、ρ的代数式表示)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏银川唐徕回民中学高一上10月化学卷(解析版) 题型:选择题
潮湿的氯气、新制的氯水、次氯酸钠、漂白粉溶液均能使有色布条褪色,这是由于它们含有或能生成
A.氯气 B.次氯酸 C.次氯酸根 D.氯化氢
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期期中测试化学试卷(解析版) 题型:实验题
过氧化氢的水溶液称为双氧水,常用作消毒剂、杀菌、漂白及工业生产原料等。
某实验小组取一定量的过氧化氢溶液,测定H2O2的含量,并探究H2O2的某些性质、应用。
Ⅰ.测定市售过氧化氢溶液中H2O2的质量分数
(1)量取10.00mL密度为ρ g/mL的市售过氧化氢溶液,应选用仪器是_______(填序号);
A.10mL量筒 B.酸式滴定管 C.碱式滴定管 D.50mL烧杯
(2)将上述溶液稀释至250mL,操作中用到的玻璃仪器是:烧杯、玻璃棒、_________(填名称);
(3)取25.00mL(2)中稀溶液至锥形瓶中,加适量稀硫酸酸化,用c mol/L KMnO4标准液滴定,
①完成反应的离子方程式:____MnO4-+___H2O2+___H+→___Mn2++___H2O+___;
②该小组一共进行了四次测定实验,实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
消耗KMnO4溶液体积/mL | 25.00 | 25.02 | 20.00 | 24.98 |
根据所给数据,计算原过氧化氢溶液中H2O2质量分数____________________________。
(4)下列操作会导致测定结果偏高的是_____________。
A.滴定前滴定管尖嘴中有气泡,滴定的气泡消失
B.将H2O2溶液稀释成250.00mL溶液时,定容俯视刻度线
C.终点时,滴入一滴KMnO4溶液,溶液呈红色,向红色溶液返滴一滴H2O2溶液仍呈红色
Ⅱ.探究H2O2的性质
(5)上述测定原理,H2O2体现__________性;
(6)若要验证H2O2不稳定性,操作是____________________________。
Ⅲ.探究H2O2的应用
(7)为研究工业生产流程中双氧水的用量、调节的pH、反应时间三个关键生产条件对产品质量的影响,需要进行七组实验,若实验序号1是该流程的理论最佳生产条件,请在下表中填入实验序号为5、6、7的三组实验条件。
实验序号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
双氧水(mL) | 0.5 | 0.4 | 0.6 | 0.5 | |||
pH | 11 | 11 | 11 | 10 | |||
反应时间 | 3 | 3 | 3 | 3 |
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上学期12月月考化学试卷(解析版) 题型:实验题
某研究小组探究SO2和Fe(NO3)3溶液的反应,其反应装置如图所示:
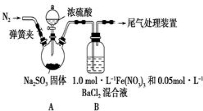
已知:l.0mol·L﹣1的Fe(NO3)3溶液的pH=l,请回答下列问题:
(1)装置A中反应的化学方程式是 。
(2)为排除空气对实验的干扰,滴加浓硫酸之前进行的操作是 。
(3)装置B中产生了白色沉淀,其成分是 , 分析B中产生白色沉淀的原因:
猜想1:SO2与Fe3+反应; 猜想2:在酸性条件下SO2与NO3﹣反应; 猜想3:…
(4)甲同学从装置B中取出适量反应后的溶液,能使KMnO4溶液褪色。
【得出结论】:猜想1成立.其结论正确吗? (填“是”或“否”)。若不正确,理由是
(用离子方程式表示)。
(5)乙同学设计实验验证猜想2,只需将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验。应选择的试剂是 (填序号)。
a.0.1mol/L稀硝酸 b.1.5mol/LFe(NO3)2溶液
c.6.0mol/LNaNO3和0.2mol/L盐酸等体积混合的溶液
d.3.0mol/LNaNO3和0.1mol/L硫酸等体积混合的溶液
(6)(4分)在实际操作中,当SO2通入Fe(NO3)3溶液时观察到的现象;溶液由黄色变为浅绿色,接着又变为黄色,请用相关离子方程式表示其过程: 、 。
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上第三次模拟考试理综化学试卷(解析版) 题型:实验题
某化学兴趣小组的同学为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,他们开展了如下探究性学习。
I.查阅资料,获取了相关知识信息:
金属的活泼性不同,其硝酸盐分解产物不同,依据金属活动顺序表:
(1)K→Na等活泼金属的硝酸盐分解生成亚硝酸盐和氧气,如:2NaNO3 2NaNO2+O2↑;
2NaNO2+O2↑;
(2)Mg→Cu等较活泼金属的硝酸盐分解生成氧化物、NO2和O2,如:2Cu(NO3)2
 2CuO+4NO2↑+O2↑;
2CuO+4NO2↑+O2↑;
(3)Hg以后不活泼金属的硝酸盐分解生成金属、NO2和O2,如:2AgNO3 2Ag+2NO2↑+O2↑.
2Ag+2NO2↑+O2↑.
Ⅱ.实验探究,在实验的基础上得到相关结论:
【实验一】探究Fe(NO3)2热分解固体产物中Fe元素的价态.该小组甲同学将Fe(NO3)2热分解固体产物溶于足量的稀H2SO4得到相应两份溶液,进行以下探究实验.
(1)提出猜想:猜想一:Fe元素只显+2价;
猜想二:Fe元素只显+3价;
猜想三:Fe元素既有+2价又有+3价。
(2)实验操作:①向一份溶液中滴入KSCN溶液;②向另一份溶液中滴入___________溶液。
(3)实验现象:实验①_________;实验②溶液不褪色。
(4)实验结论:猜想二成立,Fe(NO3)2分解的化学方程式是______________________。
【实验二】探究Fe(NO3)2热分解气体产物的性质.小组乙、丙同学进行了如图所示的实验(收集时操作恰当,几乎没有空气):

实验步骤:①连接仪器;②检查装置气密性;③取一定质量Fe(NO3)2装于大试管中,并重新连接好仪器;④加热;⑤…
(1)乙同学使用Ⅰ装置收集气体,恰好收集到27mL红棕色气体。
(2)丙同学取等质量的Fe(NO3)2同样条件下热分解,并使用Ⅱ装置收集气体产物,可收集到_____ mL气体。【实验三】探究固体混合物的组成和特征.
(1)小组丁同学取KNO3、Cu(NO3)2、Fe(NO3)2的混合粉末充分加热后用排水法未收集到任何气体,则KNO3、Cu(NO3)2、Fe(NO3)2的物质的量之比可能是________(填字母序号)。
A.1:2:3 B. l:2:2 C.2:1:3 D.3:8:5
(2)若取按上述比例混合的固体硝酸盐1mol溶于200mL 3mol•L-1的硫酸中,再向溶液中加入铜片,可溶解的铜的最大质量为__________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com