
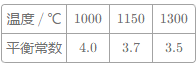
【题目】CO、CO2的应用和治理是当今社会的热点问题。CO工业上可用于高炉炼铁,发生如下反应:1/3Fe2O3(s)+CO(g)2/3Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如表:
(1)该反应的正反应为_______反应(填“放热”或“吸热”),欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是___________(选填序号)
a、及时吸收或移出CO2 b、增大反应体系的压强。
c、使用更高效的催化。 d、粉碎矿石增大接触面积
(2)一定条件下,在容积一定的容器中,铁和CO2发生反应:2Fe (s) +CO2 (g)FeO(s) +CO (g) –Q,该反应的平衡常数表达式K=____________。下列措施中能使平衡时c(CO)/c(CO2)增大的是___________(选填编号)。
a.升高温度 b.增大压强
c.充入一定量一氧化碳在 d.再加入一些铁粉
【答案】放热 a ![]() a
a
【解析】
(1)由表中数据可知,温度升高,K值减小,即反应逆向移动,而升温平衡向吸热反应方向移动,则正反应为放热反应;欲提高CO的平衡转化率,促进Fe2O3的转化,根据影响平衡移动的因素逐项进行分析;
(2)平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值,固体和纯液体不代入表达式;![]() ,则该比值就是平衡常数,而平衡常数只与温度有关,温度不变,K值不变,且正反应为吸热反应,则升温正向移动,平衡常数增大。
,则该比值就是平衡常数,而平衡常数只与温度有关,温度不变,K值不变,且正反应为吸热反应,则升温正向移动,平衡常数增大。
(1)由表中数据可知升高温度,平衡常数减小,则正反应为放热反应;
a.及时吸收或移出CO2 ,平衡正向移动,反应物转化率增大,a项正确;
b.增大反应体系的压强,平衡不移动,粉碎矿石,增大接触面积,只能加快反应速率,不影响平衡移动,b项错误;
c.用更高效的催化剂,只能加快反应速率,不影响平衡移动,c项错误;
d.粉碎矿石,增大接触面积,只能加快反应速率,不影响平衡移动,d项错误;故答案为:放热;a;
(2)一定条件下,在容积一定的容器中,铁和CO2发生反应:Fe(s)+CO2(g)![]() FeO(s)+CO(g)△H>0,该反应的平衡常数表达式K=
FeO(s)+CO(g)△H>0,该反应的平衡常数表达式K=![]() ;
;
a.正反应为吸热反应,升高温度,平衡正向移动,a项正确;
b.增大压强,平衡不一定,b项错误;
c.充入一定量CO,相当于增大压强,比值不变,c项错误;
d.再加入一些铁粉,平衡不移动,d项错误;故答案为:![]() ;a。
;a。


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:
【题目】将17.6克Fe2O3和Cu的混合物溶解于足量的稀盐酸中,再加铁粉9.8克,待铁粉溶解后,溶液中无Fe3+,此过程共产生2.24升H2(标况),则下列判断正确的是
A.混合物中Cu全部被氧化为Cu2+以后,Cu2+又全部被还原
B.混合物中Cu全部被氧化为Cu2+以后,Cu2+又部分被还原
C.混合物中Cu部分被氧化为Cu2+以后,Cu2+又全部被还原
D.混合物中Cu部分被氧化为Cu2+以后,Cu2+又部分被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容的密闭容器中按照下表甲、乙、丙三种方式分别投料,发生反应:3H2(g)+N2(g) ![]() 2NH3(g),测得甲容器中H2的平衡转化率为 40%,下列说法正确的是( ).
2NH3(g),测得甲容器中H2的平衡转化率为 40%,下列说法正确的是( ).
N2(mol) | H2(mol) | NH3(mol) | |
甲 | 1 | 3 | 0 |
乙 | 0.5 | 1.5 | 1 |
丙 | 0 | 0 | 4 |
A.乙容器中反应向逆向进行
B.达到平衡时,甲、乙、丙三容器中NH3体积分数的大小顺序:甲=乙>丙
C.乙中的NH3转化率为40%
D.若丙在恒温恒压的密闭容器进行,平衡后往容器中再充入4 mol NH3,重新达到平衡时,体系中NH3体积分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A~G是几种烃分子的球棍模型,据此回答下列问题:
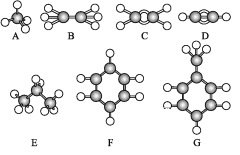
(1)上述七种烃中:
①常温下含碳量最高的气态烃是____(填结构简式)。
②能够发生加成反应的烃有____种。
③与A互为同系物的是____(填对应字母)。
④一卤代物种类最多的是____(填对应字母)。
(2)写出C发生加聚反应的化学方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列生产、生活等实际应用,不能用勒夏特列原理解释的是( )
A.实验室中配制FeCl3溶液时,应向其中加入少量浓盐酸
B.合成氨工业中使用铁触媒做催化剂
C.饱和FeCl3溶液滴入沸水中可制得氢氧化铁胶体
D.热的纯碱溶液去油污效果好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示,下列说法不正确的是( )
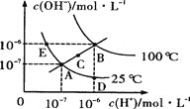
A.图中五点Kw间的关系B>C>A=D=E
B.若从A点到D点,可采用在水中加入少量酸的方法
C.若处在B点时,将pH=2的硫酸与pH=12的KOH等体积混合后,溶液显碱性
D.若从A点到C点,可用温度不变时在水中加入适量NH4Cl固体的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲~辛等元素在周期表中的相对位置如表。甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是
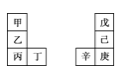
A.丙与庚的原子序数相差3
B.气态氢化物的热稳定性:戊>己>庚
C.乙所在周期元素中,其简单离子的半径最大
D.常温下甲的单质在水中反应要比乙剧烈很多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置探究铁在海水中的电化学防护,下列说法不正确的是

A.若X为锌棒,开关K置于M处,可减缓铁的腐蚀
B.若X为锌棒,开关K置于M处,铁电极的反应:Fe2e =Fe2+
C.若X为碳棒,开关K置于N处,可减缓铁的腐蚀
D.若X为碳棒,开关K置于N处,铁电极的反应:2H++2e=H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制取冰晶石(Na3AlF6)的化学方程式如下:![]()
完成下列填空:
(1)反应中四种元素对应的简单离子核外电子排布相同,请按离子半径从大到小的顺序排列这四种离子____,其中原子序数最大的元素原子核外有___种能量不同的电子,其最外层电子的电子云有____种不同的伸展方向。
(2)反应中有两种元素在元素周期表中位置相邻,能比较它们的金属性或非金属性强弱的事实是____(选填编号)。
a. 气态氢化物的稳定性 b. 最高价氧化物对应水化物的酸性
c. 单质与氢气反应的难易 d. 单质与同浓度酸发生反应的快慢
反应中两种金属元素,它们的最高价氧化物对应的水化物之间发生反应的离子方程式为_______。
(3)冰晶石在工业上可做电解氧化铝的助溶剂,此反应中若有0.6mol电子转移,则在____极可得金属铝的质量为_____克。
(4)工业上不采用电解氯化铝的方法而是采用电解氧化铝的方法获得铝单质的原因是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com