
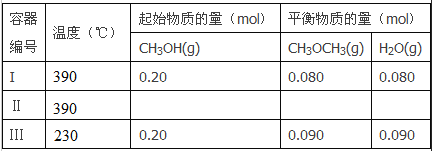
����Ŀ��һ���¶��£������������Ϊ2L�ĺ����ܱ������з�����Ӧ��
2CH3OH(g)![]() CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
�ش��������⣺
��1����Ӧ����H_________O �����������������������жϵ�������_____________������I����ƽ�������ʱ��Ϊ20s����Ӧ����v(CH3OH)Ϊ_________mol/(L��s)��390��ʱ�÷�Ӧ��ƽ�ⳣ��K1=________������ֵ����
��2������II��ƽ��ʱ��ѹǿ������I��������CH3OH���������������I�е���ͬ��CH3OH��ʼ�����ʵ���Ϊ__________��ƽ��ʱCH3OH(g)���������Ϊ___________��
��3��t���Ӻ�����III�ﵽƽ�⣬t_________20s������>����<������=�������жϵ�������________��
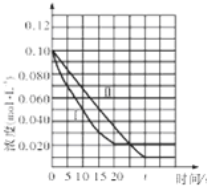
������ͼ�зֱ�����I������III��CH3OH(g)Ũ�ȱ仯������ʾ��ͼ��
��4��390��������3L�����г���0.9mol CH3OH(g), 0.6mol CH3OCH3(g)��0.3molH2O(g)������ʼʱ�÷�Ӧ����V��_________V�档������>����<������=����
���𰸡���1��<��1�֣���Ͷ������ͬʱ���¶ȸߵ�������ƽ��ʱ�����ѵ����ʵ���С��˵����ӦΪ���ȷ�Ӧ����HС��0����2�֣�0.004��2�֣���K1=4��1�֣�����2��0.40mol��1�֣���0.4��1�֣���
��3��>(1��)���״�����ʼŨ����ͬ��������I���¶ȴ�������III���¶ȣ��¶�Խ�ߣ��ٶ�Խ�죻
��4��>��2�֣�
��������
�����������1����ѧƽ�ⳣ���Ĵ�Сֻ���¶��йأ������¶ȣ�ƽ�������ȵķ����ƶ�����Ӧ��������ʼ����ͬ������CH3OCH3��g�������ͣ�˵�����������ƶ�������ӦΪ���ȹ��̣�������HС��0��
2CH3OH��g��![]() CH3OCH3��g��+H2O��g��
CH3OCH3��g��+H2O��g��
��ʼ����mol�� 0.2 0 0
ת������mol�� 0.16 0.08 0.08
ƽ������mol�� 0.04 0.08 0.08
����v��CH3OH��=![]() =0.004molL-1min-1
=0.004molL-1min-1
ƽ�ⳣ��K=c(CH 3OCH 3)c(H 2O)/c 2(CH 3OH) =0.08��0.08/0.042=4
��2����������ƽ��ʱ��CH3OH������������������е���ͬ����Ϊ��Чƽ�⣬�ָ÷�ӦΪ�����������ķ�Ӧ������ֻҪ��Ӧ��ɱ�������Ч����ѹǿ��������ƽ��ʱ�������������������Կ�ʼ��Ӧ��ҲӦ��������������������CH3OH��ʼ�����ʵ���Ϊ0.40mol����Чƽ������ʵ����������ͬ������ƽ��ʱCH3OCH3��g���������������������ͬ�����ݣ�1��������ʽ����������ƽ��ʱCH3OCH3��g�����������Ϊ![]() =0.4������������ƽ��ʱCH3OCH3��g�����������ҲΪ0.4��
=0.4������������ƽ��ʱCH3OCH3��g�����������ҲΪ0.4��
��3���¶�Խ�ͣ���Ӧ����ԽС���ﵽƽ��ʱ�����ʱ��Խ������������ȣ������¶ȵͣ���Ӧ����ԽС����Ҫ��ʱ�䳤������t���Ӻ��������ﵽƽ�⣬t����20min�������������������������ݣ���ʼʱCH3OH��g��Ũ����ͬ��ƽ��ʱ������CH3OH��g��Ũ��Ϊ(0.200.08��2)/2=0.02mol/L��ƽ��ʱ������CH3OH��g��Ũ��Ϊ(0.200.09��2)/2=0.01mol/L������ͼ��Ϊ�����𰸣���
��4��c��CH3OH��=0.9��3=0.3mol/L��c��CH3OCH3 ��=0.6��3=0.2mol/L��c��H2O��=0.3��3=0.1mol/L��Ũ����=��0.2��0.1��/0.32=2/9����Ϊ390��ʱ�÷�Ӧ��ƽ�ⳣ��K=4������ƽ��������Ӧ�����ƶ���v����v����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��̬������ϩ���Ļ����9g�����ܶ�Ϊ��ͬ״���������ܶȵ�11.2�������������ͨ����������ˮ����ˮ����4.2g����ԭ�����������Ϊ�� ��
A����������ϩ B����������ϩ C���������ϩ D�������붡ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ������ͭ��100 mLһ��Ũ�ȵ����ᷴӦ��ͭ��ȫ�ܽ�ʱ������NO��NO2��������ڱ�״���µ����Ϊ11.2 L��������������ȫ���ͷź�����Һ����140mL 5 mol��L��1��NaOH��Һ��ǡ��ʹ��Һ�е�Cu2+ ȫ��ת���ɳ�������ԭ������Һ�����ʵ���Ũ���ǣ� ��
A. 5 mol/L B. 7 mol/L C. 10mol/L D. 12 mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ�Dѡ��5���л���ѧ������
�л���AΪ����������ͼ��������Է�������Ϊ70������ط�Ӧ����ͼ��ʾ������B��D��E�Ľṹ�о�����2��-CH3,���ǵĺ˴Ź��������о�����4���塣
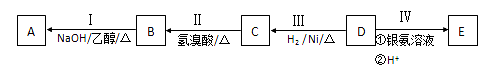
��ش�
��1��B�����������ŵ�����Ϊ ��D�ķ���ʽΪ ��
��2����ķ�Ӧ����Ϊ ������ĸ��ţ���
a����ԭ��Ӧ b���ӳɷ�Ӧ c��������Ӧ d����ȥ��Ӧ
��3��д�����з�Ӧ�Ļ�ѧ����ʽ��
�� ��
�� ��
��4��C��E����һ�������·�Ӧ����F��FΪ����ζ���л�������÷�Ӧ�Ļ�ѧ����ʽΪ ��
��5��A��ͬ���칹������һ�Ի�Ϊ˳���칹���ҽṹ����2��-CH3�����ǵĽṹ��ʽΪ__________��____________��
��6��E����һ��ͬ���칹���ܷ���������Ӧ�����������������������������ܷ�����ȥ��Ӧ����ṹ��ʽΪ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����( )
A�����ʵ���֬�����ŵ�������ζ����������֬������ˮ�ⷴӦ
B�����»��ճ��õ���������ʹ�����в��������ʱ���
C��������ë��ľ�ĺͲ������Ҫ�ɷֶ�����ά��
D����ʳ�ؽ��������������ж����ɺȴ�����ʳ��ˮ�ⶾ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������п�������Ļ��Լ�����ǿ����������п��Ʒ�������������CuO��SiO2�����ʣ�Ϊԭ���Ʊ���������п��������������Ʒ��������������������
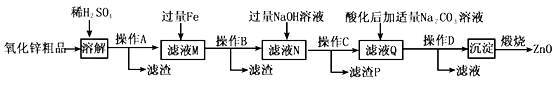
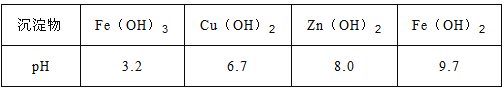
��֪��Zn(OH)2������NaOH��Һ��һЩ������������������ʽ��ȫ����ʱ��Һ��pH���±���
��1������A���õIJ����������ձ���©����______________��
��2�����ܽ⡱ǰ������п��Ʒ�����ϸ������Ŀ����____________________��
��3������������ɻ��յĽ�����_______________��
��4��������������ҺN�м���������H2O2��Һ���ټ�һ����ij�Լ�������ҺpH=5����Fe3+Ũ��Ϊ__________����֪Ksp[Fe(OH)3]=4.0��10-34��
��5����K3[Fe(CN)6]�����軯�أ���֤N��Fe2+��������___________��
��6�����������ijɷ�ΪZnCO3��2Zn(OH)2��H2O�������ա���450��500���½��У����ջ��ZnO�ķ�Ӧ�Ļ�ѧ����ʽΪ_____________________��
��7��ȡ20.00mL�˶�N����0.02mol/L��KMnO4��Һ���еζ�������KMnO4��Һ18.00mL������ҺN��Fe2+��Ũ��Ϊ__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з��ӻ������У�VSEPRģ����������ӻ����ӵ����幹�����Ʋ�һ�µ��ǣ� ��
A��CO2 B��H2O C��CO32�� D��CCl4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������벻��ȼ�ϡ�δ������������ȼ����( )
A��ú B��ʯ�� C����Ȼ�� D������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѡ���У��й�ʵ�����������ͽ��۶���ȷ����( )
ѡ�� | ʵ����� | �� �� | �� �� |
A | ��������CO2ͨ��CaCl2��Һ�� | �ް�ɫ�������� | ���ɵ�Ca(HCO3)2������ˮ |
B | �����½�AlƬ����Ũ������ | ���������� | AlƬ��Ũ�����Ӧ |
C | �ò�����պȡŨ��ˮ�㵽��ɫʯ����ֽ�� | ��ֽ����ɫ | Ũ��ˮ�ʼ��� |
D | ��SO2ͨ����ˮ�� | ��Һ��ɫ | SO2����Ư���� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com