
【题目】将一定质量铜与100 mL一定浓度的硝酸反应,铜完全溶解时产生的NO和NO2混合气体在标准状况下的体积为11.2 L。待产生的气体全部释放后,向溶液加入140mL 5 mol·L-1的NaOH溶液,恰好使溶液中的Cu2+ 全部转化成沉淀,则原硝酸溶液的物质的量浓度是( )
A. 5 mol/L B. 7 mol/L C. 10mol/L D. 12 mol/L
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.生成物总能量一定低于反应物总能量
B.酒精可用作燃料,说明酒精燃烧是放热反应
C.硝酸铵溶于水温度降低,这个变化是吸热反应
D.同温同压下,H2和Cl2在光照和点燃条件下的ΔH不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列框图中的物质均为中学化学中常见物质,其中甲、乙为单质,其余均为化合物。B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物,G遇KSCN溶液显红色。

请回答下列问题:
(1)A B, C, D, E,
(2)反应①~⑤中,属于氧化还原反应的是 (填序号)。
(3)反应⑤的化学方程式为 ;
甲与B反应的离子方程式为 。
A与B反应的离子方程式为 。
(4)在空气中将C溶液滴入F溶液中,观察到的现象是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物:①正戊烷 ②异戊烷 ③新戊烷 ④正丁烷 ⑤异丁烷,它们的沸点按由高到低的顺序排列正确的是( )
A.①>②>③>④>⑤ B.⑤>④>③>②>①
C.①>②>④>③>⑤ D.①>②>③>⑤>④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A+B![]() 3C+4D反应中,表示该反应速率最快的是 ( )
3C+4D反应中,表示该反应速率最快的是 ( )
A.VA==0.5 mol/(Ls) B. VB==0.3 mol/(Ls)
C.VC==4.8 mol/(Lmin) D. VD==1 mol/(Ls)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中前者属于取代反应,后者属于加成反应的是( )
A. 光照甲烷与氯气的混和物,乙烯使酸性高锰酸钾溶液褪色
B. ![]() ,乙烯与水蒸汽在一定条件生成乙醇
,乙烯与水蒸汽在一定条件生成乙醇
C. 乙烯使溴的四氯化碳溶液褪色 ,苯与氢气在一定条件下反应生成环己烷
D. 在苯中滴入溴水,溴水褪色 , 乙烯使溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于①乙烯、②苯、③乙醇、④乙酸、⑤葡萄糖等有机物的叙述不正确的是( )
A.可以用新制的Cu(OH)2悬浊液鉴别③④⑤
B.只有①③⑤能使酸性KMnO4溶液褪色
C.只有②③④能发生取代反应
D.一定条件下,⑤可以转化为③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积都为2L的恒容密闭容器中发生反应:
2CH3OH(g)![]() CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
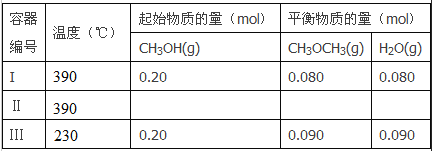
回答下列问题:
(1)反应的△H_________O (填“>”或“<”);判断的理由是_____________。容器I到达平衡所需的时间为20s,反应速率v(CH3OH)为_________mol/(L·s)。390℃时该反应的平衡常数K1=________(填数值)。
(2)容器II达平衡时,压强是容器I的两倍,CH3OH的体积分数和容器I中的相同,CH3OH起始的物质的量为__________;平衡时CH3OH(g)的体积分数为___________。
(3)t分钟后容器III达到平衡,t_________20s(填“>”“<”或“=”)。判断的理由是________。
请在右图中分别画出容器I和容器III中CH3OH(g)浓度变化的曲线示意图。
(4)390℃,若向3L容器中充入0.9mol CH3OH(g), 0.6mol CH3OCH3(g)和0.3molH2O(g),则起始时该反应速率V正_________V逆。(填“>”“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少Mg(ClO3)2·6H2O的流程如下:

已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②几种化合物的溶解度(S)随温度(T)变化曲线如图。

(1)加MgO后过滤所得滤渣的主要成分为 _____。
(2)加入BaCl2的目的是除去SO42-,如何检验SO42-已沉淀完全? ___。
(3)加入NaClO3饱和溶液会发生如下反应:MgCl2+2NaClO3![]() Mg(ClO3)2+2NaCl↓,请利用该反应,结合右图,制取Mg(ClO3)2·6H2O的实验步骤依次为: ①取样,加入NaClO3饱和溶液充分反应,②蒸发结晶;③ ;④ ;⑤过滤、洗涤。
Mg(ClO3)2+2NaCl↓,请利用该反应,结合右图,制取Mg(ClO3)2·6H2O的实验步骤依次为: ①取样,加入NaClO3饱和溶液充分反应,②蒸发结晶;③ ;④ ;⑤过滤、洗涤。
(4)将产品先用水洗涤,再用无水乙醇清洗。无水乙醇的作用是___________________。
产品中Mg(ClO3)2·6H2O(其相对分子质量为299)含量的测定:
步骤1:准确称量3.50g产品溶解定容成100mL溶液。
步骤2:取10mL于锥形瓶中,加入10mL稀硫酸和20mL1.000mol/L的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100mol/LK2Cr2O7溶液滴定至终点。此过程中反应的离子方程式为:
Cr2O72-+6Fe2++14H+![]() 2Cr3++6Fe3++7H2O。
2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00mL。
(5)写出步骤2中发生的离子方程式_______________________。
(6)上述产品测定中需要检查是否漏液的仪器有_____________________。
步骤3中若滴定前不用标准液润洗滴定管,会导致最终结果偏___________(填“大”或“小”)。
(7)产品中Mg(ClO3)2·6H2O的质量分数为 ______ 。(计算结果保留两位小数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com