
下列说法或表示方法正确的是 ( )。
A.反应物的总能量低于生成物的总能量时,反应一定不能自发进行
B.已知:H2S(g)+aO2(g)=x+bH2O(l) ΔH,若ΔH表示H2S的燃烧热,则x为SO2(g)
C.已知:2SO2(g)+O2(g)??2SO3(g) ΔH=-98.3 kJ·mol-1,在密闭容器中充入1 mol SO2和0.5 mol O2,充分反应后放出49.15 kJ的热量
D.由石墨比金刚石稳定可得:C(s,金刚石)=C(s,石墨) ΔH>0
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源:2014年江苏省南通市业水平测试(必修)化学试卷(解析版) 题型:选择题
下列说法正确的是
A.石墨是电解质 B.干冰是氧化物
C.铝热剂是纯净物 D.冰醋酸是混合物
查看答案和解析>>
科目:高中化学 来源:2014年化学高考题型专练十三 有机物结构及同分异构体数目判断练习卷(解析版) 题型:选择题
下列有关说法正确的是 ( )。
A.丙烯的结构简式为CH2CHCH3
B.2,2-二甲基丙烷的一氯代物有2种
C.分子式为CH4O和C2H6O的物质一定互为同系物
D.键线式为 的有机物的分子式为C8H8
的有机物的分子式为C8H8
查看答案和解析>>
科目:高中化学 来源:2014年化学高考题型专练十 电解质溶液中微粒浓度的关系练习卷(解析版) 题型:选择题
常温时,将a1 mL、b1 mol·L-1的CH3COOH溶液加入到a2 mL、b2 mol·L-1的NaOH溶液中,下列结论中正确的是 ( )。
A.如果a1b1=a2b2,则混合溶液的pH=7
B.如果混合液的pH=7,则混合溶液中c(CH3COO-)=c(Na+)
C.如果a1=a2,b1=b2,则混合溶液中c(CH3COO-)=c(Na+)
D.如果a1=a2,且混合溶液的pH>7,则b1<b2
查看答案和解析>>
科目:高中化学 来源:2014年化学高考题型专练六 盖斯定律应用与热化学方程式的书写练习卷(解析版) 题型:选择题
已知:H+(aq)+OH-(aq)=H2O(l) ΔH1=-57.3 kJ·mol-1,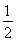 H2SO4(浓,aq)+NaOH(aq)=
H2SO4(浓,aq)+NaOH(aq)=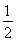 Na2SO4(aq)+H2O(l) ΔH2=m kJ·mol-1。下列说法正确的是 ( )。
Na2SO4(aq)+H2O(l) ΔH2=m kJ·mol-1。下列说法正确的是 ( )。
A.上述热化学方程式中的化学计量数表示分子个数
B.ΔH1>ΔH2
C.ΔH2=-57.3 kJ·mol-1
D.|ΔH1|>|ΔH2|
查看答案和解析>>
科目:高中化学 来源:2014年化学高考题型专练八 化学反应速率和化学平衡分析与判断练习卷(解析版) 题型:选择题
合成氨反应为:N2(g)+3H2(g) 2NH3(g)。图1表示在一定的温度下此反应过程中的能量的变化,图2表示在2 L的密闭容器中反应时N2的物质的量随时间的变化曲线,图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在一定的温度下此反应过程中的能量的变化,图2表示在2 L的密闭容器中反应时N2的物质的量随时间的变化曲线,图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。

下列说法正确的是 ( )。
A.由图1可得加入适当的催化剂,E和ΔH都减小
B.图2中0~10 min内该反应的平均速率v(H2)=0.045 mol·L-1·min-1,
从11 min起其他条件不变,压缩容器的体积为1 L,则n(N2)的变化曲线为d
C.图3中A、B、C三点所处的平衡状态中,反应物N2的转化率最高的是B点
D.图3中T1和T2表示温度,对应温度下的平衡常数为K1、K2,则:T1>T2,K1>K2
查看答案和解析>>
科目:高中化学 来源:2014年化学高考题型专练五 元素周期表中位-构-性关系的分析练习卷(解析版) 题型:选择题
甲、乙、丙、丁、戊是中学化学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去)。下列说法不正确的是
( )。
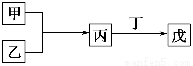
A.若组成甲、乙的元素位于同一周期,则戊可能是一种弱酸
B.若组成甲、乙的元素位于同一主族,则戊可能是一种弱酸
C.若甲为短周期中原子半径最大的主族元素形成的单质,且戊为碱,则丙只能为Na2O2
D.若丙、丁混合生成白烟,且丙为18电子分子,丁为10电子分子,则乙的水溶液可能具有漂白作用
查看答案和解析>>
科目:高中化学 来源:2014年化学高考题型专练三 特定条件下离子方程式的书写与判断练习卷(解析版) 题型:选择题
下列离子方程式书写正确的是 ( )。
A.澄清石灰水与少量小苏打溶液混合:Ca2++2OH-+2HCO3—=CaCO3↓+CO32—+2H2O
B.磁性氧化铁置于氢碘酸溶液中:Fe3O4+8HI=2Fe3++Fe2++4H2O+8I-
C.NaHSO4溶液中滴加过量Ba(OH)2溶液:H++SO42—+Ba2++OH-=BaSO4↓+H2O
D.醋酸与氨水混合:CH3COOH+NH3·H2O=CH3COONH4+H2O
查看答案和解析>>
科目:高中化学 来源:2014年化学高考课时演练 7-3化学平衡常数化学反应进行方向练习卷(解析版) 题型:选择题
某温度下,对于反应N2(g)+3H2(g) 2NH3(g)ΔH=-92.4 kJ/mol。N2的平衡转化率(α)与体系总压强(p)的关系如图所示。下列说法正确的是( )
2NH3(g)ΔH=-92.4 kJ/mol。N2的平衡转化率(α)与体系总压强(p)的关系如图所示。下列说法正确的是( )

A.将1 mol氮气、3 mol氢气,置于1 L密闭容器中发生反应,放出的热量为92.4 kJ
B.平衡状态由A变到B时,平衡常数K(A)<K(B)
C.上述反应在达到平衡后,增大压强,H2的转化率增大
D.升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com