
���ھ�������β���ķ�Ӧ��2NO��g��+2CO��g��⇌2CO2��g��+N2��g������֪�÷�Ӧ570Kʱƽ�ⳣ��Ϊ1��1059������Ӧ���ʼ���������˵����ȷ���ǣ�������
| �� | A�� | װ��β������װ�õ������ų��������в��ٺ���NO��CO |
| �� | B�� | ���β������Ч�ʵij��÷����������¶� |
| �� | C�� | ����ѹǿ������ƽ�����ƣ��ʿ�ͨ����ѹ�ķ������β������Ч�� |
| �� | D�� | ���β������Ч�ʵ����;����ʹ�ø�Ч���� |
| ��ѧƽ���Ӱ�����أ�. | |
| ר�⣺ | ��ѧƽ��ר�⣮ |
| ������ | A����Ӧ�ǿ��淴Ӧ�����ܽ��г��ף� B��β���¶��Ѿ��ܸߣ��������¶ȵ����岻�� C����ƽ�ⳣ��������Ӧ���г̶ȣ������豸����Ч������� D����߾������ʵ���÷�����ʹ�ø�Ч������ |
| ��� | �⣺A���÷�ӦΪ���淴Ӧ��������ȫת�����ų���������һ������NO��CO����A���� B��β���¶��Ѿ��ܸߣ��������¶ȣ���Ӧ����������ޣ������ĸ�����Դ�����岻��B���� C����ƽ�ⳣ���Ѿ��ϴ�����ѹǿ��Ȼƽ�������ƶ��������豸Ҫ����ߣ����������ɾ���Ч�棬��C���� D�����Ƹ�Ч��������߷�Ӧ���ʣ������Ӧ���������⣬������β����ת������C��ȷ�� ��ѡD�� |
| ������ | ���⿼�黯ѧ��Ӧ�������⣬��Ŀ�ѶȲ���ע����������Ϣ��Ϊ������Ĺؼ�������ʱע���������⣮ |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij���۽�����̼���κ���ʽ̼���εĻ�����������ϡ���ᷴӦ������H+������CO2���ʵ���֮��Ϊ6��5����û������̼���κ���ʽ̼���ε����ʵ���֮���� �� ��
A��1:1 B��1:2 C��1: 3 D��1:4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ؾ��н�Ѫѹ�����ã���ṹ��ʽ����ͼ�������й�˵����ȷ����
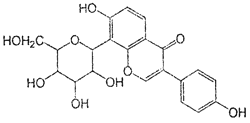
A����������һ���������ܷ�����ȥ��Ӧ���ӳɷ�Ӧ��ȡ����Ӧ
B������صķ���ʽΪC21H22O9
C��������һ�������к���5������̼ԭ��
D��һ��������1 mol ��������H2��Ӧ���������7 mol H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
(1)б��ʯ��KAlSi3O8����NaCl�۽����Ƶ�KCl��ԭ���ǣ�
NaCl(l) + KAlSi3O8(s) KCl(l)+ NaAlSi3O8(s)��
KCl(l)+ NaAlSi3O8(s)��
��. б��ʯ���еĻ�ѧ��������_________________��
��. ������Ӧ�漰��Ԫ��ԭ���У��뾶������ ��������Ԫ���γɵĻ�����ĵ���ʽΪ __________��
��2�������£�pH=3��HCOOH��Һ��pH=11��NaOH��Һ�������Ϻ���Һ������Ũ��
��С��˳��Ϊ������������������������������������������������������������������
��3��������(H2SeO3)Ҳ��һ�ֶ�Ԫ���ᣬ��������һ����ɫ���壬������ˮ���н�ǿ�������ԡ�
��.����������Һ�в���ͨ��SO2 ��������ɫ���ʣ�д���÷�Ӧ�Ļ�ѧ����ʽ��
���������������������� ��������������������������������������������
�� .���ᣨH6TeO6�������Ա�Ũ���ỹҪǿ�������Խ����У�����ɽ�HI������I2������ʽ���£����� ��HI+���� ��H6TeO6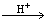 ���� ��TeO2+�� ����Te+���� ��I2+�� ����H2O
���� ��TeO2+�� ����Te+���� ��I2+�� ����H2O
����Ӧ�����ɵ�TeO2��Te�����ʵ���֮��Ϊ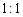 ������ƽ������ѧ����ʽ��
������ƽ������ѧ����ʽ��
��֪Cu(OH)2 ���ܽ��������İ�ˮ�У��������ӷ�Ӧ����ʽΪ����������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����˵����ȷ���ǣ�������
�ٲμӷ�Ӧ�����ʵ�������Ӱ�컯ѧ��Ӧ���ʵ���Ҫ���آڹ���Ӱ��ijЩ��ѧ��Ӧ���ʵ��������֮һ�۾�����ѧ��Ӧ���ʵ���Ҫ������Ũ�ȡ��ܲ���ʲô��Ӧ������Ũ�ȣ�����Ȼ��ѹ����ʹ�ô����������Լӿ췴Ӧ���ʣ�
| �� | A�� | �٢� | B�� | �ڢ� | C�� | �ۢ� | D�� | �٢� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪����N2��g��+O2��g���T2NO��g����H1=+180kJ•mol��1
��N2��g��+3H2��g��⇌2NH3��g����H2=��92.4kJ•mol��1
��2H2��g��+O2��g���T2H2O��g����H3=��483.6kJ•mol��1
����˵����ȷ���ǣ�������
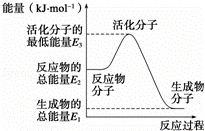
| �� | A�� | ��Ӧ���е������仯��ͼ��ʾ�����H2=E1��E3 |
| �� | B�� | H2��ȼ����Ϊ241.8 kJ•mol��1 |
| �� | C�� | �ɷ�Ӧ��֪���¶�һ���������£���һ�����ܱ�������ͨ��1 mol N2��3 mol H2����Ӧ��ų�������ΪQ1 kJ����ͨ��2 mol N2��6 mol H2��ַ�Ӧ��ų�������ΪQ2 kJ����184.8��Q2��2Q1 |
| �� | D�� | ���Ĵ�������ӦΪ4NH3��g��+5O2��g���T4NO��g��+6H2O��g����H=+906 kJ•mol��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪�ϳɰ��ķ�ӦΪN2��g��+3H2��g��⇌2NH3��g����H=��92.4 kJ•mol��1��
�������Ϊ5L�ĺ��¡������ܱ��������У���ʼʱͶ��2mol N2��3mol H2������10s�ﵽƽ�⣬���ƽ��ʱNH3�����ʵ���Ϊ0.8mol��
�����������У���ʼʱͶ��3mol N2��b mol H2��ά�ֺ��¡���ѹ�ﵽƽ�⣬���ƽ��ʱNH3�����ʵ���Ϊ1.2mol����ʱ����������ƽ��״̬�¶���ͬ����ͬ��ֵ������������ͬ��
��1��������10s����H2��ʾ��ƽ����Ӧ����v��H2��=��0.024mol•L��1•s��1������ƽ��ʱN2��ת����=��20%����
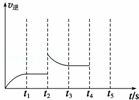
��2���������з�Ӧ���淴Ӧ������ʱ��仯�Ĺ�ϵ��ͼ��t2ʱ�ı���ijһ���������ı�����������ǡ��������¶ȡ����������˰���Ũ�ȡ�����д�����
��3��������Щ��������������Ѵ�ƽ��״̬��ACD��������ĸ����
A���������е������ܶȲ��ٱ仯
B���������������ʵ��ڵ������������ʵ�2��
C������1mol N��N��ͬʱ����6mol N��H��
D���������������ƽ����Է�����������ʱ����仯��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����þ���ص��κ�ˮ���������õ��IJ����к���±ʯ��xKCl��yMgCl2��zH2O�������ڿ����м��׳��⣬������ˮ��������طʺ���ȡ����þ����Ҫԭ�ϣ�����ɿ�ͨ������ʵ��ⶨ��
��ȷ��ȡ5.550 g��Ʒ����ˮ�����100 mL��Һ��
�ڽ���Һ�ֳɶ��ȷݣ���һ���м���������NaOH��Һ��������ȫ�����ˡ�ϴ�ӡ����������أ��õ���ɫ����0.580 g��
������һ����Һ�м��������������ữ��AgNO3��Һ��������ȫ�����ˡ�ϴ�ӡ����������أ��õ���ɫ����4.305 g��
��1��������м����ɫ������ϴ���ķ����� ��
��2����֪ij�¶���Mg(OH)2��Ksp = 6.4��10��12������Һ��c(Mg2+)��1.0��10��5 mol��L��1 ����Ϊ������ȫ����Ӧ������Һ��OH����Ũ�ȡ� mol��L��1 ��
��3��ͨ������ȷ����Ʒ����ɣ�д��������̣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ʵ�鷽���У����ܴﵽʵ��Ŀ�ĵ���
| ѡ�� | ʵ��Ŀ�� | ʵ�鷽�� |
| A | ����CH3CH2Br��NaOH��Һ���Ƿ���ˮ�� | ��CH3CH2Br��NaOH��Һ���ȡ���ȴ��ȡ���ϲ�ˮ��Һ��ϡHNO3�ữ����AgNO3��Һ���۲��Ƿ��������ɫ���� |
| B | ����Fe(NO3)2�����Ƿ����������� | ��Fe(NO3)2��Ʒ����ϡH2SO4�μ�KSCN��Һ���۲���Һ�Ƿ��� |
| C | ��֤Br2��������ǿ��I2 | ��������ˮ����KI��Һ�У��ټ���CCl4�������á��ɹ۲쵽�²�Һ�����ɫ |
| D | ��֤Fe(OH)3���ܽ��С��Mg(OH)2 | ��FeCl3��Һ����Mg(OH)2����Һ�У����ɹ۲쵽�����ɰ�ɫ��Ϊ���ɫ |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com