
【题目】磷酸二氢钾(KH2PO4)是一种大型非线性光学晶体,在未来能源领域——“人造太阳”计划中有重要作用.以氯磷灰石(主要成分为Ca5(PO4)3Cl,还含有少量Al2O3、Fe2O3等杂质)为原料制备KH2PO4的一种工艺流程如图所示:
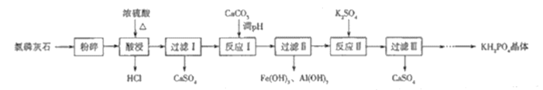
已知:①离子完全沉淀时的pH为Fe3+:3.5,Al3+:5.2.
②Ca3(PO4)2与CaHPO4均难溶于水,Ca(H2PO4)2能溶于水
(1)已知“酸浸”时发生反应的化学方程式为![]() ,该反应体现了浓硫酸的______________________性和___________________性.
,该反应体现了浓硫酸的______________________性和___________________性.
(2)如果将原料改为氟磷灰石,则“酸浸”时不能使用玻璃容器,原因是______________________.
(3)“反应Ⅱ”的化学方程式为________________________________________.
(4)常温下磷酸的电离平衡常数![]() 、
、![]() 、
、![]() ,
,![]() 的电离常数
的电离常数![]() 、
、![]() ,则常温下KH2PO4水溶液显____________________(填“酸性”“碱性”或“中性”);将少量磷酸滴入碳酸钠溶液中反应的离子方程式为______________________________.
,则常温下KH2PO4水溶液显____________________(填“酸性”“碱性”或“中性”);将少量磷酸滴入碳酸钠溶液中反应的离子方程式为______________________________.
(5)KH2PO4也可以通过如图所示装置电解制备:
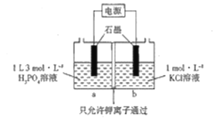
则阳极的电极反应式为___________________.假如通电前a、b两室溶液的质量相等,若有2NA个K+通过交换膜,则两室溶液的质量差为__________________g.
【答案】强酸 难挥发 生成的HF会与玻璃中的SiO2反应 K2SO4+Ca(H2PO4)2=2KH2PO4+CaSO4↓ 酸性 H3PO4+2CO![]() =HPO
=HPO![]() +2HCO
+2HCO![]() +H2O 2Clˉ-2eˉ=Cl2↑ 225g
+H2O 2Clˉ-2eˉ=Cl2↑ 225g
【解析】
氯磷灰石[主要成分为Ca5(PO4)3Cl,还含有少量Al2O3、Fe2O3等杂质]粉碎,加入浓硫酸酸浸,并加热,生成HCl气体,过滤得到微溶物硫酸钙,滤液含有磷酸、硫酸铁、硫酸铝等,加入碳酸钙调节pH,生成氢氧化铝、氢氧化铁沉淀,过滤在得到的滤液中加入硫酸钾,生成硫酸钙,同时生成KH2PO4,经系列操作得到KH2PO4晶体,以此解答该题。
(1)该反应中生成磷酸体现了浓硫酸的强酸性,生成HCl体现了浓硫酸的难挥发性;
(2)根据酸浸时发生的反应可知若将原料改为氟磷灰石会生成HF,而HF会与玻璃中的SiO2发生反应,所以不能使用玻璃容器;
(3)根据所给条件“Ca3(PO4)2与CaHPO4均难溶于水,Ca(H2PO4)2能溶于水”可知加入硫酸钾前溶液中的溶质主要为Ca(H2PO4)2,所以“反应II”的化学方程式为K2SO4+Ca(H2PO4)2=2KH2PO4+CaSO4↓;
(4)KH2PO4溶液中存在H2PO![]() 的电离和水解,其电离平衡常数为Ka2=6.3×10-8,其水解平衡常数Kh=
的电离和水解,其电离平衡常数为Ka2=6.3×10-8,其水解平衡常数Kh=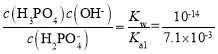 =1.4×10-12<6.3×10-8,即电离程度更大,所以溶液显酸性;根据题意可知酸性:H3PO4>H2CO3>H2PO
=1.4×10-12<6.3×10-8,即电离程度更大,所以溶液显酸性;根据题意可知酸性:H3PO4>H2CO3>H2PO![]() >HCO
>HCO![]() >HPO
>HPO![]() ,所以将少量磷酸滴入碳酸钠溶液中反应的离子方程式为H3PO4+2CO
,所以将少量磷酸滴入碳酸钠溶液中反应的离子方程式为H3PO4+2CO![]() =HPO
=HPO![]() +2HCO
+2HCO![]() +H2O;
+H2O;
(5)该装置需要制备KH2PO4,所以电解过程中钾离子要向左侧移动,则左侧为阴极,右侧为阳极,阳极的电解质溶液为KCl溶液,所以氯离子在阳极放电生成氯气,电极反应式为:2Clˉ-2eˉ=Cl2↑;左侧为阴极,氢离子放电生成氢气,电极反应式为2H++2eˉ=H2↑,通电前两室质量相等,若有2NA个K+通过交换膜,即右室有2molK+进入左室,根据电极反应式可知同时右室生成1mol氯气,左室生成1mol氢气,则两室溶液的质量差为39g/mol×4mol+71g/mol×1mol-2g/mol×1mol=225g。


科目:高中化学 来源: 题型:
【题目】25°C, 在 0. 1 mol L-1 的CH3COOH 溶液中滴加 NaOH溶液,溶液中c(CH3COOH)、c(CH3COO-)与 pH的关系如图所示。下列叙述正确的是
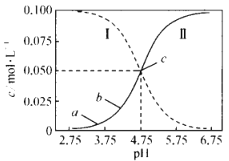
A.曲线I表示混合溶液中c(CH3COO-)随pH变化关系
B.a点溶液的导电能力比b点的强
C.25℃时,CH3COOH的电离平衡常数为10-4.75
D.pH=5.5的溶液中:c(Na+)>c(CH3COO-)>c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子在指定溶液中能大量共存的是
A.0.1mol·L-1NaOH溶液:Na+、K+、![]() 、
、![]()
B.0.1mol·L-1Fe2(SO4)3溶液:Cu2+、![]() 、SCN-、
、SCN-、![]()
C.0.1mol·L-1Na2S溶液:Na+、K+、ClO-、OH-
D.0.1mol·L-1NH4HCO3溶液:Ba2+、K+、OH-、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过二硫酸( )极易溶于水,且在水中会逐渐水解得到硫酸和过氧化氢:H2S2O8+H2O=H2SO4+H2SO5、H2SO5+H2O=H2SO4+H2O2,下列说法中错误的是
)极易溶于水,且在水中会逐渐水解得到硫酸和过氧化氢:H2S2O8+H2O=H2SO4+H2SO5、H2SO5+H2O=H2SO4+H2O2,下列说法中错误的是
A.过二硫酸与高锰酸钾溶液反应可产生氧气
B.过二硫酸铵溶于水所得溶液显酸性
C.将过二硫酸加入滴有紫色石蕊试液的水中,溶液显红色
D.过二硫酸可用来除去稀硫酸中的亚硫酸杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】沼气是重要的生物质能,主要由有机废弃物发酵产生,其成分有CH4、CO2和H2S等,由沼气获得高纯度CH4的工作原理如图所示(交换膜左侧为酸性溶液,右侧为碱性溶液),下列说法中错误的是
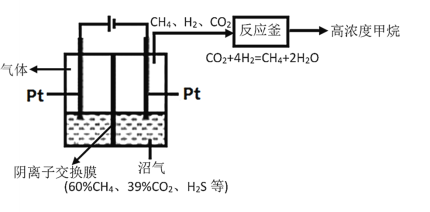
A.对沼气池进行检修时应预先通风并戴防毒面具
B.阴离子应从左侧向右侧迁移
C.在阳极上可能发生反应:HS--2e-=S↓+H+
D.一定条件下反应釜中的反应能自发进行,主要原因是该反应放热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列说法正确的是
A. 124 g P4含有P—P键的个数为4NA B. 12 g石墨中含有C—C键的个数为1.5NA
C. 12 g金刚石中含有C—C键的个数为4NA D. 60gSiO2中含Si—O键的个数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铅蓄电池为电源.将CO2转化为乙烯的装置如图所示,电解所用电极材料均为惰性电极。下列说法不正确的是( )
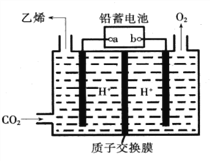
A. b为铅蓄电池的正极
B. 每生成1mol乙烯,理论上铅蓄电池中消耗12mol硫酸
C. 电解过程中,阳极区溶液中c(H+)逐渐减小
D. 阴极反应式:2CO2+12H++12e-=C2H4+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国西昌卫星发射中心用“长征三号丙”运载火箭成功发射嫦娥二号探月卫星,火箭的燃料之一是铝粉与高氯酸铵(NH4ClO4)的固体混合物,点燃时,铝粉被氧化放热引发高氯酸铵反应:2NH4ClO4=N2↑+4H2O+Cl2↑+2O2↑,反应放出大量的热。
(1)该反应中被氧化的元素是_____________。
(2)对该反应的反应类型判断正确的是_____________。
A.氧化还原反应B.复分解反应C.置换反应D.分解反应
(3)该反应中若生成1moLCl2,则电子转移数为_____________个。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com