
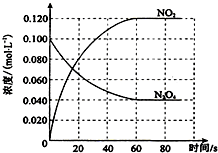
 在容积为100L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.
在容积为100L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.分析 (1)随温度的升高,混合气体的颜色变深,化学平衡向正反应方向移动,据此判断;
(2)①N2O4的浓度降低,平衡向正反应方向移动,由于正反应方向吸热,T>100℃;
②计算T℃时两种物质的浓度,计算得到化学平衡常数;
(3)反应容器的容积减少一半,压强增大,根据反应前后气体体积大小判断化学平衡移动方向.
解答 解:(1)随温度的升高,混合气体的颜色变深,化学平衡向正反应方向移动,即△H>0;故答案为:大于;
(2)①N2O4的浓度降低,平衡向正反应方向移动,由于正反应方向吸热,T>100℃,故答案为:大于;
②平衡时,c(NO2)=0.120mol•L-1+0.0020mol•L-1•s-1×10s×2=0.16mol•L-1,c(N2O4)=0.040mol•L-1-0.0020mol•L-1•s-1×10s=0.020mol•L-1,K2=$\frac{(0.16mol/L)^{2}}{0.020mol/L}$=1.3mol/L,故答案为:=1.3;
(3)反应容器的容积减少一半,压强增大,正反应方向气体体积增大,增大压强向着气体体积减小的方向移动,故答案为:逆反应;对气体分子数增大的反应,增大压强平衡向逆方向移动.
点评 本题考查化学平衡图象、影响平衡的因素、平衡常数影响因素、化学反应速率的计算等,注意根据图象判断平衡时刻,根据平衡时的浓度计算平衡常数.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-12 |
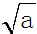 mol•L-1.
mol•L-1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Al3+、Cl-、SO42- | B. | H+、Na+、Fe2+、NO3- | ||
| C. | K+、Cu2+、NO3-、OH- | D. | H+、NH4+、AlO2-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气与烧碱溶液反应:Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | 氧化亚铁与稀盐酸反应:FeO+3H+═Fe3++H2O | |
| C. | 氯化亚铁溶液中通入氯气:2Fe2++Cl2═2Fe3++2 Cl- | |
| D. | 金属钠与水反应:2Na+2H2O═2 Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原性Cl->Fe2+ | B. | 熔点Al2O3>Al | ||
| C. | 稳定性Fe(OH)2>Fe(OH)3 | D. | 碱性Al(OH)3>NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca+、Cl-、CO32-、Na+ | B. | Cl-、CO32-、Na+、H+ | ||
| C. | H+、Ba2+、OH-、NO3- | D. | Mg2+、Na+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠存放于煤油中 | |
| B. | NaOH溶液盛放在带橡皮塞的试剂瓶中 | |
| C. | 新制的氯水保存在棕色玻璃试剂瓶中 | |
| D. | 漂白粉露置在空气中保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ①③ | C. | ①⑤ | D. | ③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com