
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-12 |
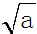 mol•L-1.
mol•L-1.分析 (1)水的离子积kw=c(H+)•c(OH-),而纯水显中性c(H+)=c(OH-),据此分析;
(2)硫酸钠溶液是显中性的;
(3)混合液的pH=2,酸过量,根据c(H+)=$\frac{n({H}^{+})-n(O{H}^{-})}{{V}_{总}}$计算,根据反应后溶液的组成分析各种离子的浓度大小.
解答 解:(1)t1℃时水的离子积kw=c(H+)•c(OH-),而纯水显中性c(H+)=c(OH-),故c (H+)=$\sqrt{a}$,故答案为:$\sqrt{a}$;
(2)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol/L,则溶液中钠离子浓度是1×10-3 mol/L.如果稀释100倍,则钠离子浓度是1×10-5 mol/L.但硫酸钠溶液是显中性的,所以c(Na+):c(OH-)=10-5:10-7=100:1,故答案为:100:1;
(3)混合液的pH=2,酸过量,c(H+)=$\frac{n({H}^{+})-n(O{H}^{-})}{{V}_{总}}$=$\frac{0.01mol/L×{V}_{2}L-0.1mol/L×{V}_{1}L}{({V}_{1}+{V}_{2})L}$=0.01,
解之得:$\frac{{V}_{1}}{{V}_{2}}$=9:2,
c(Na+)=0.01×9/(9+2)=0.0082mol/L
c(SO42-)=0.05×2/11=0.09mol/L
c(H+)=0.01mol/L
硫酸过量溶液显酸性,则(H+)>c (OH-),
故溶液中各种离子的浓度由大到小的排列顺序是:c(H+)>c(SO42-)>c(Na+)>c(OH-)故答案为:9:2;c(H+)>c(SO42-)>c(Na+)>c(OH-).
点评 本题考查了水的电离、溶液中离子浓度大小比较以及pH计算,题目难度中等,该题是高考中的常见题型,属于中等难度的试题;该题的关键是明确溶液中几个重要守恒关系,即电荷守恒、物料守恒和质子守恒.


科目:高中化学 来源: 题型:选择题
| A. | 已知X在一定条件下转化为Y,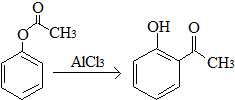 ,X与Y互为同分异构体,可用FeCl3溶液鉴别 ,X与Y互为同分异构体,可用FeCl3溶液鉴别 | |
| B. | 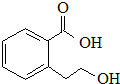 能发生的反应类型有:加成反应、取代反应、消去反应、水解反应 能发生的反应类型有:加成反应、取代反应、消去反应、水解反应 | |
| C. | 淀粉、蛋白质最终的水解产物都只有一种 | |
| D. | 香柠檬粉具有抗氧化功能,结构为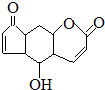 它与溴水发生反应,1mol最多消耗3molBr2,它与NaOH溶液反应,1mol最多消耗2molNaOH 它与溴水发生反应,1mol最多消耗3molBr2,它与NaOH溶液反应,1mol最多消耗2molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1,则氢气的标准燃烧热为-483.6kJ/mol | |
| B. | △H的数值与化学反应方程式的化学计量系数无关 | |
| C. | 含20.0g NaOH的稀溶液与稀硫酸完全中和,放出28.7kJ的热量,则该反应的热化学方程式为:NaOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.4 kJ•mol-1 | |
| D. | 己知C(s)+O2(g)═CO2(g)△H1;C(g)+O2(g)═CO2(g)△H2,则△H1<△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14g乙烯和环丙烷混合物中含有的碳原子数目为NA | |
| B. | 1.6g甲烷完全燃烧生成二氧化碳和水,转移的电子数为0.8NA | |
| C. | 0.1mol乙炔分子中含有的共用电子对数目为0.5NA | |
| D. | 在标准状态下,2.24L己烷含有的氢原子数目为1.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 右图的键线式表示烃的名称为:3-甲基-4-乙基-7-甲基辛烷 | |
| B. | 符合分子式为C3H8O的醇有三种不同的结构 | |
| C. | 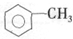 中,所有原子不可能都在同一平面上 中,所有原子不可能都在同一平面上 | |
| D. | 治疗疟疾的青蒿素(如图)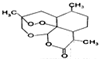 ,分子式是C15H20O5 ,分子式是C15H20O5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
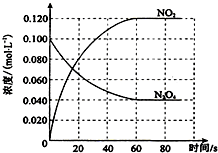 在容积为100L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.
在容积为100L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钙(CaO2)的电子式: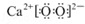 | |
| B. | 某微粒的结构示意简图为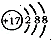 ,则该元素在周期表中位于第三周期、VIA族 ,则该元素在周期表中位于第三周期、VIA族 | |
| C. | H2CO3的电离方程式:H2CO3?2H++CO32- | |
| D. | 葡萄糖的结构简式:C6H12O6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com