
| A. | 已知2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1,则氢气的标准燃烧热为-483.6kJ/mol | |
| B. | △H的数值与化学反应方程式的化学计量系数无关 | |
| C. | 含20.0g NaOH的稀溶液与稀硫酸完全中和,放出28.7kJ的热量,则该反应的热化学方程式为:NaOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.4 kJ•mol-1 | |
| D. | 己知C(s)+O2(g)═CO2(g)△H1;C(g)+O2(g)═CO2(g)△H2,则△H1<△H2 |
分析 A、燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量分析;
B、△H的数值与化学反应方程式的化学计量系数成正比;
C、依据酸碱中和热的概念分析,中和热是强酸强碱的稀溶液完全反应生成1mol水放出的热量;
D、固体到气体要吸热,反应热大小比较包括正负.
解答 解:A、燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量分析,选项中水是气体不是液态氧化物,故燃烧热大于241.8kJ/mol,故A错误;
B、△H的数值与化学反应方程式的化学计量系数成正比,故B错误;
C、依据酸碱中和热的概念分析,中和热是强酸强碱的稀溶液完全反应生成1mol水放出的热量,含20.0g NaOH物质的量为0.5mol的稀溶液与稀硫酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.4kJ/mol,故C正确;
D、固体到气体要吸热,反应热大小比较包括正负,所以气体碳放出的热量多,而反应热大小比较包括正负,所以△H1>△H2,故D错误;
故选C.
点评 本题考查了燃烧热、中和热概念的理解应用,反应热大小比较,注意焓变为负值,题目难度中等.


 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:解答题
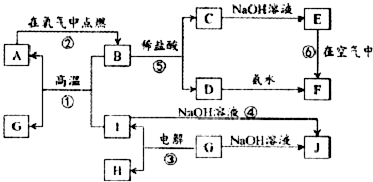
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
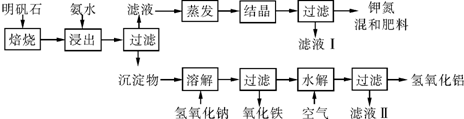
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
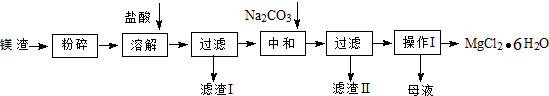
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸具有吸水性,因而能使蔗糖炭化 | |
| B. | 蓝色的胆矾晶体中加入浓硫酸,晶体会转化为白色固体 | |
| C. | 浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体 | |
| D. | 常温下,浓硫酸不与铁、铝反应,所以可以用铁、铝制容器盛装浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 陶瓷、玻璃、水泥容器都能贮存氢氟酸 | |
| B. | 硅酸钠属于盐,不属于碱,所以硅酸钠可以保存在磨口玻璃塞的试剂瓶中 | |
| C. | 用SiO2制取硅酸,应先使二氧化硅与氢氧化钠溶液反应,然后再通入CO2 | |
| D. | 由Na2CO3+SiO2 $\frac{\underline{\;高温\;}}{\;}$CO2+Na2SiO3可知硅酸的酸性大于碳酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-12 |
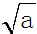 mol•L-1.
mol•L-1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca+、Cl-、CO32-、Na+ | B. | Cl-、CO32-、Na+、H+ | ||
| C. | H+、Ba2+、OH-、NO3- | D. | Mg2+、Na+、Cl-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com