
下列有关实验装置进行的相应实验,能达到实验目的的是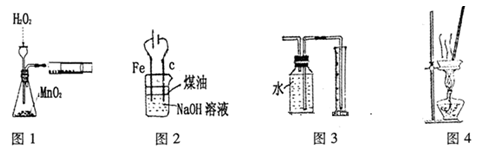
| A.图l装置可用于定量测定H2O2的分解速率 |
| B.图2装置制备Fe(OH)2并能较长时间观察其颜色 |
| C.图3装置测量Cu与浓硝酸反应产生气体的体积 |
| D.图4装置可用于蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
科目:高中化学 来源: 题型:单选题
下列说法中正确的是( )
| A.常温下,浓硫酸、浓硝酸均能将金属铜氧化,且均能使铁钝化 |
| B.乙烯常用作植物催熟剂,乙酸常用作调味剂,乙醇常用于杀菌消毒 |
| C.玛瑙、水晶、钻石的主要成分均为SiO2 |
| D.用CCI4萃取碘水中的I2时,紫色溶液从分液漏斗的上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
用18.4 mol·L-1的浓硫酸配制100 mL浓度为1 mol·L-1的稀硫酸,其操作可分为以下各步:
| A.用量筒量取5.4 mL浓硫酸,缓慢倒入装有约50 mL蒸馏水的烧杯里,并用玻璃棒搅拌 |
| B.用约30 mL蒸馏水,分成三次洗涤烧杯和玻璃棒,将洗涤液都倒入容量瓶中 |
| C.将稀释后的硫酸小心地倒入容量瓶中 |
| D.检查100 mL容量瓶口是否有漏液现象 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
.(16分)化学实验是科学探究的基础。请回答有关实验问题:
(1)下面的四个实验装置有三个都存在明显缺陷,其中完全正确的是 :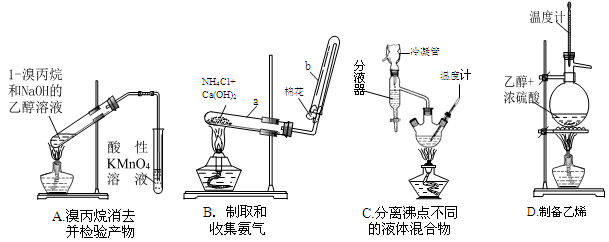
(2)要检验上面B装置氨气已集满的操作是 则试管已集满。
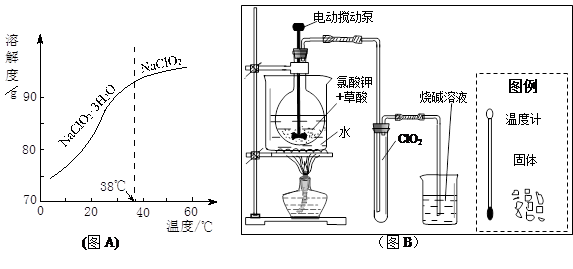
(3)ClO2是一种安全、高效、广谱、强力杀菌剂,其性质如右表:
①由下表可以看出:保存液态ClO2的条件是密封、 ;ClO2与碱反应的离子方程式 ;观察下“图A”,要从NaClO2溶液制得不含结晶水的晶体,操作是蒸发结晶,控制条件是 ;应控制析出晶体的温度范围是 。
| 色态 | 溶于碱 | 超过1Kpa、受热或遇光 | |
| 常温气体 | -59-11℃ 红黄色液体 | 生成亚氯酸盐和氯酸盐 | 爆炸 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(4分)下列有关实验操作或判断不正确的是 _____________(填序号,多选扣分)。
| A.配制一定物质的量浓度溶液,定容时俯视刻度线会导致所配溶液浓度偏大 |
| B.少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗 |
| C.配制稀硫酸时,可先在烧杯中加入一定体积的蒸馏水,再边缓慢加入浓硫酸边搅拌 |
| D.100 mL容量瓶可用于配制95 mL 0.1 mol/L NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(15分)S2Cl2常用于橡胶硫化、有机物氯化的试剂,实验室可利用如下装置来制备S2Cl2。(部分夹持仪器已略去)
已知:①制备的反应方程式为:
②反应涉及的几种物质性质如下:
| 性质 物质 | 熔点 | 沸点 | 着火点 | 其他性质 |
| 单斜硫 | 119.2℃ | 446.6℃ | 363℃ | / |
| 斜方硫 | 112.8℃ | 446.6℃ | 363℃ | / |
| S2Cl2 | -77℃ | 137℃ | / | 遇水强烈分解生成S、SO2和HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
亚硝酸钠(NaNO2)是一种外观与食盐相似的食品添加剂。某化学兴趣小组进行如下实验。
【实验I】
用如下装置(已省略夹持装置)制NaNO2。
已知:2NO+Na2O2=2NaNO2;2NO2+Na2O2=2NaNO3。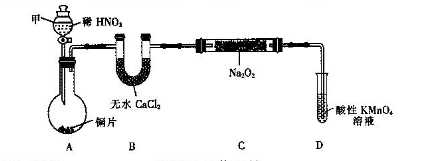
(1)仪器甲的名称是________.装置B的作用是_________________________。
(2)装置D可将剩余的NO氧化成NO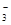 ,发生反应的离子方程式为_____________。
,发生反应的离子方程式为_____________。
(3)使用气密性良好的上述装置进行实验,NaNO2的纯度较低。为提高NaNO2纯度须对
上述实验装置或药品进行改进,其改进措施是________________________________。
【实验Ⅱ】
利用目视比色法(比较溶液颜色深浅以测定物质浓度)测定泡菜样品中NaNO2的含量。
步骤i:在5个有编号的试管中分别加入不同量的NaNO2溶液,各加入1 mL的M溶液 (M遇NaNO2呈紫红色,NaNO2浓度越大颜色越深),再加蒸馏水至总体积均为l0 mL并振荡,制成标准色阶。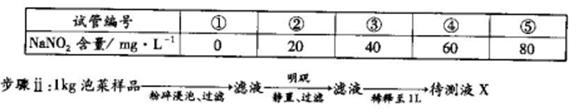
步骤ⅲ:取5 mL待测液X,加入1 mLM溶液,加蒸馏水至10mL振荡,与标准色阶比较。
(4)步骤ii获取待测液X的过程中,加入明矾的目的是__________。
(5)步骤iii比较结果与④号色阶颜色相同,此泡菜样品中NaNO2的含量为_________mg·kg-1
(6)用目视比色法证明泡菜中加入维生素C可以降低NaNO2的含量。设计并完成下列实
验报告。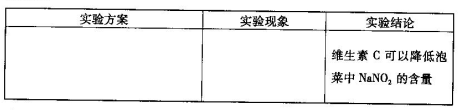
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
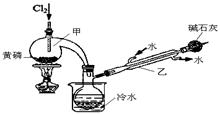
PCl3可用于半导体生产的外延、扩散工序。有关物质的部分性质如下:
| | 熔点/℃ | 沸点/℃ | 密度/g·mL-1 | 其他 |
| 黄磷 | 44.1 | 280.5 | 1.82 | 2P(过量)+3Cl2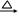 2PCl3;2P+5Cl2(过量) 2PCl3;2P+5Cl2(过量) 2PCl5 2PCl5 |
| PCl3 | -112 | 75.5 | 1.574 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
| POCl3 | 2 | 105.3 | 1.675 | 遇水生成H3PO4和HCl,能溶于PCl3 |
 H3PO4+2HI;b.(NH4)3BO3溶液可与HI和H3PO4反应生成H3BO3(弱酸);c.Na2S2O3溶液可定量测定碘:I2+2Na2S2O3→Na2S4O6+2NaI
H3PO4+2HI;b.(NH4)3BO3溶液可与HI和H3PO4反应生成H3BO3(弱酸);c.Na2S2O3溶液可定量测定碘:I2+2Na2S2O3→Na2S4O6+2NaI查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某实验小组为研究草酸的制取和草酸的性质,进行如下实验。
实验I:制备草酸
实验室用硝酸氧化淀粉水解液制备草酸的装置如图所示(加热、搅拌和仪器固定装置均已略去),实验过程如下:
①将一定量的淀粉水解液加人三颈瓶中
②控制反应液温度在55?600C条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸 (65%HNO3与98%H2S04的质量比为2 :1.5)溶液
③反应3h左右,冷却,抽滤后再重结晶得草酸晶体。
硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2↑+8NO↑+10H2O
3 H2C2O4+2HNO3→6CO2↑+2NO↑+4H2O
(1)检验淀粉是否水解完全所需用的试剂为________。
(2)实验中若混酸滴加过快,将导致草酸产率下降,其原因是________。
实验II:草酸晶体中结晶水测定
草酸晶体的化学式可表示为H2C2O4? xH2O,为测定x的值,进行下列实验:
①称取6.3g某草酸晶体配成100.0mL的水溶液。
②取25.00mL所配溶液置于锥形瓶中,加入适量稀H2SO4,用浓度为0. 5mol/L的KMnO4溶液滴定,滴定终点时消耗KMnO4的体积为10.00mL。回答下列问题:
(3)写出上述反应的离子方程式________________。
(4)计算x=________。
(5)滴定时,常发现反应速率开始很慢,后来逐渐加快,可能的原因是________。
实验III:草酸不稳定性
查阅资料:草酸晶体(H2C2O4 ?xH20),1000C开始失水,100.5℃左右分解产生H2O、CO和CO2。请用下图中提供的仪器及试剂,设计一个实验,证明草酸晶体分解得到的混合气中有H2O、CO和CO2 (加热装置和导管等在图中略去,部分装置可重复使用)。
回答下列问题:
(6)仪器装置按连接顺序为________。
(7)仪器B中无水硫酸铜的作用________。
(8)能证明混合气中含有CO的实验依据是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com