
.(16分)化学实验是科学探究的基础。请回答有关实验问题:
(1)下面的四个实验装置有三个都存在明显缺陷,其中完全正确的是 :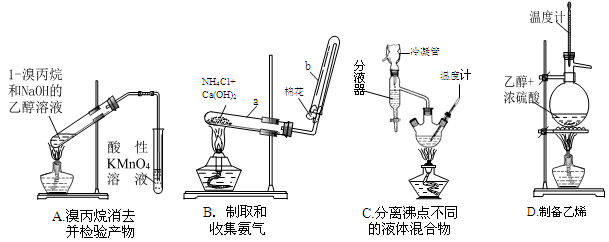
(2)要检验上面B装置氨气已集满的操作是 则试管已集满。
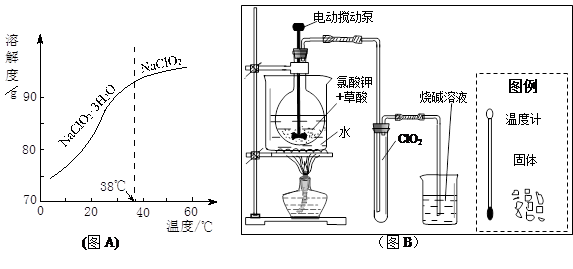
(3)ClO2是一种安全、高效、广谱、强力杀菌剂,其性质如右表:
①由下表可以看出:保存液态ClO2的条件是密封、 ;ClO2与碱反应的离子方程式 ;观察下“图A”,要从NaClO2溶液制得不含结晶水的晶体,操作是蒸发结晶,控制条件是 ;应控制析出晶体的温度范围是 。
| 色态 | 溶于碱 | 超过1Kpa、受热或遇光 | |
| 常温气体 | -59-11℃ 红黄色液体 | 生成亚氯酸盐和氯酸盐 | 爆炸 |
33.(16分)
(1)(2分)B(2分) (2)(2分)取用水湿润的pH试纸(或红色石蕊试纸,或粘有浓盐酸的玻棒)靠近b管口(1分),若试纸变红
(或有白烟,1分))
(3)(12分)① 低温避光(2分) ClO2+2OH-==ClO2-+ClO3-+H2O(2分,化学式、系数各1分) 减压蒸发(2分。说明:从溶解度曲线可以看出,常压在略高于38℃时蒸发留在母液中的NaClO2太多,只有减压时蒸发,在略高于38℃时水分挥发多一些、母液少一些。若答为38-60℃或之间的数值给1分)略高于(或大于)38℃(2分)
②(见下图)其中画出温度计位置正确1分、标注1分,画出烧怀和冰(或冰水)1分、标注1分。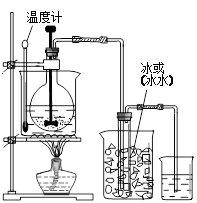
解析试题分析: (1)此处考查几个基础实验的装置、原理和重要仪器的使用。A项中卤代烃消去制备不饱和烯烃,由于反应在醇溶液中进行,反应又是加热的,所以不能直接把气体通入酸性高锰酸钾溶液中,因为乙醇易挥发也能使高锰酸钾褪色,A错误;B中是固-固加热制备氨气,正确;C项蒸馏操作分离互溶的液体混合物,但选用了三颈烧瓶错误,温度计水银球放置是测蒸气组分的沸点的,应该在支管口附近,C错误;D装置是实验室制备乙烯的装置图,但实验中控制的是反应溶液的温度170度,因此D错误。故选B。
(2)上述B装置是实验室制备NH3的实验装置图,若该装置的氨气已满,则氨气会通过棉花而逸出,所以只需用湿润的红色的石蕊试纸放在支管口即可,若试纸变蓝,则说明氨气已满;当然氨气的检验还有一种,即用蘸有浓盐酸的玻璃棒靠近试管口,若冒白烟,则说明氨气已满。
(3)①保存液态ClO2主要是要克服压强、温度、光照等条件,所以此处最好除了密封保存外,还要保证低温避光等条件。由于表格中已提到ClO2与碱反应生成亚氯酸盐和氯酸盐,因此此反应的离子方程式可以根据这一提示得出ClO2-和ClO3- ;溶液中反应由水产生,所以总的离子方程式为ClO2+2OH-==ClO2-+ClO3-+H2O。从曲线图来看,由NaClO2溶液制备晶体,有两种,所以要制得不含结晶水的晶体,则应该保证温度高于38℃蒸发结晶,但是又从图像看出,NaClO2 的溶解度较大,如果常温下蒸发,则水分蒸发少,溶液水分多则会导致NaClO2 大量残留在溶液中,所以只有减压蒸发,才能在38℃下让水分蒸发的多一些,得到更多的NaClO2 晶体。应该控制的温度范围要保证效率,所以尽量在略高于(或大于)38℃左右即可,温度过高则产;率增大不明显。
②此发生装置必须要控制反应的温度在60℃,因此在此处设置的水浴加热装置应该要补充温度计,同时要制得液态ClO2 ,则收集ClO2 的试管应该在冰水浴中,所以应该在试管周围补充冰水浴装置,此处所给的的图例没有烧杯,但是必须根据实验要求自己补充。
考点:本题考查的是基础实验题。


 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:填空题
化学实验中,同一个装置可以用于不同的实验,例如图的实验装置(B中可为固体或液体,可加热)。
(1)若A中为浓盐酸,B中为高锰酸钾固体,D中为石蕊溶液,则D中现象为________________________。
(2)若A中为足量的浓硝酸,B中为铜单质,D中用NaOH来吸收其产生的气体,请写出D中所发生的反应的化学方程式________________________________________________。
(3)若A中为浓H2SO4,B中为NaCl固体, D中是Na2S与Na2SO3的混合溶液,打开分液漏斗后,加热,D中出现黄色沉淀并有臭鸡蛋气味的气体逸出,则D中n(Na2S)与n(Na2SO3)需满足的条件是______________________________。
(4)该装置可以模拟氨碱法制纯碱,D中为饱和食盐水。先制取________气体通入D中至饱和,再制取_______气体也通入D中,此时可以看到溶液中有晶体析出。请写出该反应的化学方程式___________________________________________________。
(5)利用上述装置,下列实验不可能实现的是_____________________
| A.证明碳酸比苯酚的酸性强 | B.证明氯气的氧化性比溴强 |
| C.用乙醇制备并检验乙烯 | D.制备并收集乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
实验室模拟回收某废旧含镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等)生产Ni2O3。其工艺流程为: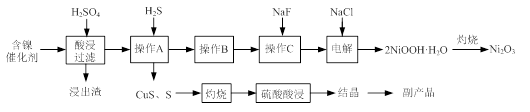
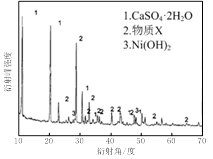
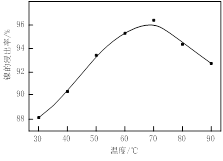
图Ⅰ 图Ⅱ
(1)根据图Ⅰ所示的X射线衍射图谱,可知浸出渣含有三种主要成分,其中“物质X”为 。图Ⅱ表示镍的浸出率与温度的关系,当浸出温度高于70℃时,镍的浸出率降低,浸出渣中Ni(OH)2含量增大,其原因是 。
(2)工艺流程中“副产品”的化学式为 。
(3)已知有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
草酸是一种重要的试剂。下面是利用草酸探究浓度对反应速率影响的实验。
(1)为证明浓度对反应速率的影响,曾有教科书《化学反应原理》设计了如下实验:取两支试管,各加入4mL0.01mol·L-1的KMnO4酸性溶液,分别向其中加入0.1 mol·L-1、0.2 mol·L-1 H2C2O4溶液2mL,记录溶液褪色所需时间。
实验中发生反应的离子方程式为: ;
预期现象是:
①溶液的颜色由 色变为 色,
②其中加入 mol·L-1H2C2O4的那支试管中的溶液先变色。
然而实验结果并不尽如人意。实验过程颜色复杂,且褪色先缓慢,后逐渐加快;最大的问题是草酸浓度大,反应速率却更慢。
本实验能否作为课堂实验研究浓度对化学反应速率的影响?适宜的条件是怎样的?某校一研究小组对此进行了探究。下面是他们的实验报告的一部分:
表1 试验安排及结果
| 实验 编号 | A(KMnO4溶液浓度/mol·L-1) | B(草酸溶液浓度/mol·L-1) | C(硫酸溶液浓度/mol·L-1) | 褪色时间/s |
| 1 | 3 | 3 | 1 | 336 |
| 2 | 1 | 2 | 3 | 82 |
| 3 | 3 | 1 | 3 | 76 |
| 4 | 1 | 3 | 2 | 133 |
| 5 | 2 | 3 | 3 | 102 |
| 6 | 3 | 2 | 2 | 156 |
| 7 | 2 | 2 | 1 | 300 |
| 8 | 2 | 1 | 2 | 115 |
| 9 | 1 | 1 | 1 | 200 |
| | A(KMnO4溶液) | B(草酸溶液) | C(硫酸溶液) | ||||||
| 浓度/mol·L-1 | 0.005 | 0.010 | 0.015 | 0.1 | 0.5 | 0.9 | 6 | 12 | 18 |
| 平均褪色时间/s | 138.3 | 172.3 | 189.3 | 130.3 | 179.3 | 190.3 | 278.7 | 134.7 | 86.7 |
| c(H2SO4)/mol·L-1 | 18 | 16 | 14 | 12 | 10 | 8 | 6 |
| 褪色时间/s | 67 | 83 | 90 | 103 | 129 | 146 | 200 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(11分)某化学小组设计实验探究碳酸钠、碳酸氢钠的性质,实验如下:取两支试管分别加入10 mL相同浓度的稀盐酸,将两个各装有0 5 g的Na2CO3和NaHCO3粉末的小气球分别套在两个试管上,将气球内的固体粉末同时倒人试管中,已知盐酸足量,观察实验现象。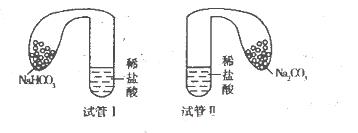
(l)两支试管中均产生气体,其中产生气体较快的为________(填“试管I”或“试管II”),投入________(填化学式)的试管中气球变得比较大。
(2)甲同学触摸上述两试管,发现试管I变冷,试管Ⅱ变热,由此提出不管其状态如何,NaHCO3与HCl反应为吸热反应,Na2CO3与HCl反应为放热反应。
为进一步探究Na2CO3、NaHCO3与盐酸反应的能量变化,乙同学进行下列实验,操作步骤为:①向试剂1中加入试剂2,搅拌、测定温度;②静置、测定温度;③再加入试剂3.搅拌、测定温度、记录。得到以下数据: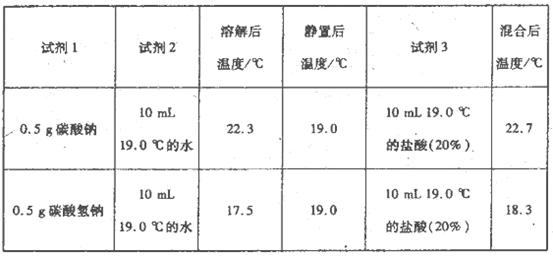
上述实验需要用到的玻璃仪器有________。
乙同学可得出结论:
①NaHCO3的溶解过程________(填“吸热”或“放热”,下同);Na2CO3的溶解过程________。
②CO32-与H+反应为一反应(填“放热”或“吸热”,下同),HCO3-与H+反应为________反应。
(3)比较甲乙同学的实验,你认为 ________(填“甲”或“乙”)的实验方案更合理、更严密。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
下列有关实验装置进行的相应实验,能达到实验目的的是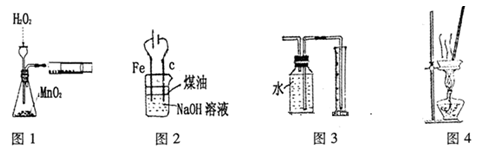
| A.图l装置可用于定量测定H2O2的分解速率 |
| B.图2装置制备Fe(OH)2并能较长时间观察其颜色 |
| C.图3装置测量Cu与浓硝酸反应产生气体的体积 |
| D.图4装置可用于蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某同学欲配制0.1 mol/LBa(OH)2溶液,但只找到在空气中暴露已久的Ba(OH)2试剂。配制溶液时发现所取试剂在水中仅部分溶解,烧杯中存在大量未溶物。
(1)他猜测烧杯中未溶物为BaCO3。理由是_____________;检验方法是_______________。
(2)为准确测定样品中Ba(OH)2的含量。进行如下实验:
①配制250 mL约0.1 mol/L Ba(OH)2溶液:称取5.000 g试样,置于烧杯中,加适量蒸馏水,充分搅拌溶解,静置过滤,得滤液和沉淀,将滤液转入______中,洗涤,定容,摇匀。
②滴定:准确量取25.00 mL所配制Ba(OH)2溶液于锥形瓶中,滴加2滴甲基橙,将0.200 mol/L标准盐酸装入滴定管,滴定至终点,记录数据。重复滴定2次。平均消耗盐24.20 mL。计算样品中Ba(OH)2的质量分数为____________。
(3)上述滴定中,滴定管在注入标准盐酸之前,先用蒸馏水洗净,再用________________。在滴定中,准确读数应该是滴定管上蓝线的________________处所对应的刻度。滴定终点的现象是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
孔雀石主要含Cu2(OH)2CO3,还含少量Fe的氧化物和SiO2,实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下: 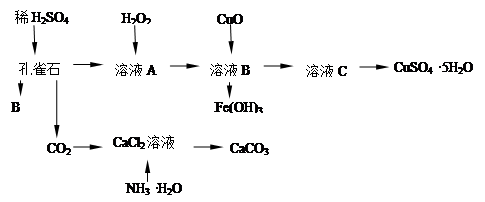
试回答下列问题:
(1)B物质的化学式是 在未加入H2O2的溶液中,存在的金属离子有Cu2+、Fe2+、Fe3+。若检验该溶液中Fe3+,选择最合适的试剂是 (填代号)。
| A.KMnO4溶液 | B.Fe粉 | C.Na2CO3溶液 | D.KSCN溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com