
化学实验中,同一个装置可以用于不同的实验,例如图的实验装置(B中可为固体或液体,可加热)。
(1)若A中为浓盐酸,B中为高锰酸钾固体,D中为石蕊溶液,则D中现象为________________________。
(2)若A中为足量的浓硝酸,B中为铜单质,D中用NaOH来吸收其产生的气体,请写出D中所发生的反应的化学方程式________________________________________________。
(3)若A中为浓H2SO4,B中为NaCl固体, D中是Na2S与Na2SO3的混合溶液,打开分液漏斗后,加热,D中出现黄色沉淀并有臭鸡蛋气味的气体逸出,则D中n(Na2S)与n(Na2SO3)需满足的条件是______________________________。
(4)该装置可以模拟氨碱法制纯碱,D中为饱和食盐水。先制取________气体通入D中至饱和,再制取_______气体也通入D中,此时可以看到溶液中有晶体析出。请写出该反应的化学方程式___________________________________________________。
(5)利用上述装置,下列实验不可能实现的是_____________________
| A.证明碳酸比苯酚的酸性强 | B.证明氯气的氧化性比溴强 |
| C.用乙醇制备并检验乙烯 | D.制备并收集乙酸乙酯 |
(1)先变红后褪色(2分);
(2)2NO2 +2NaOH→NaNO3 +NaNO2+H2O(2分);
(3)n(Na2S) > `2n(Na2SO3)(2分);
(4)NH3 CO2 (共1分) NH3 + CO2+NaCl + H2O → NaHCO3↓ + NH4Cl(1分);
(5)C(2分);
(6)NaOH NaAlO2 (合理即可)(2分);
解析试题分析:(1)浓盐酸和高锰酸钾固体发生反应生成氯气,另外浓盐酸易挥发出氯化氢,因此出来的气体是氯气和氯化氢的混和气体,当遇到D中的石蕊溶液时,氯气与水反应有次氯酸生成有漂白性,故D中现象为先变红后褪色。
(2)浓硝酸和铜单质反应生成二氧化氮气体,二氧化氮和NaOH反应的化学方程式2NO2 +2NaOH→NaNO3 +NaNO2+H2O。(3)浓H2SO4和NaCl固体反应生成氯化氢气体, 氯化氢和D中是Na2S与Na2SO3的混合溶液反应后,生成黄色沉淀是硫,臭鸡蛋气味的气体是硫化氢,要有硫化氢气体放出,根据化学方程式2H2S +SO2 ="3S" +2H2O ,则D中n(Na2S)与n(Na2SO3)需满足的条件是n(Na2S) > `2n(Na2SO3)。(4)氨碱法制纯碱,选是把氨气通入到食盐水中,再通入二氧化碳气体,溶液中有晶体碳酸氢钠析出。反应方程式为NH3 + CO2+NaCl + H2O → NaHCO3↓ + NH4Cl。(5)要用乙醇制备乙烯要用到浓硫酸做催化剂并控制温度170℃,该装置中没有温度计无法测定,选C。(6)稀硫酸和碳酸氢钠固体反应生成二氧化碳气体,D中先无现象,后慢慢产生沉淀且不溶解,据此可知D溶液的原溶质可能是NaOH或NaAlO2。
考点:本题考查实验装置与实验原理的选择。


 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:单选题
完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是
| | A | B | C | D |
| 实验 | 用CCl4提取碘水中的I2 | 分离乙醇中的I2 | 加热分解 MgCl2?6H2O得到 纯净的MgCl2 | 配制100mL 0.1000mol/L K2Cr2O7溶液 |
| 装置或仪器 |  |  |  |  |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法中正确的是( )
| A.常温下,浓硫酸、浓硝酸均能将金属铜氧化,且均能使铁钝化 |
| B.乙烯常用作植物催熟剂,乙酸常用作调味剂,乙醇常用于杀菌消毒 |
| C.玛瑙、水晶、钻石的主要成分均为SiO2 |
| D.用CCI4萃取碘水中的I2时,紫色溶液从分液漏斗的上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
为了将混有K2SO4、MgSO4的KNO3固体提纯,并制得纯净的KNO3溶液,某学生设计如下实验方案: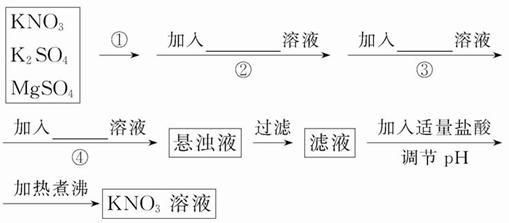
(1)操作①为___________________________。
(2)操作②~④加入的试剂依次可以为:___________________________________________________。
(3)如何判断SO42-已除尽?____________________________。
(4)实验过程中产生的多次沉淀_______ (填“需要”或“不需要”)多次过滤,其理由是_______________________________________________________。
(5)该同学的实验设计方案是否严密?请说明理由:___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO。制备流程如下:
已知:Zn及其化合物的性质与Al及其化合物的性质相似。请回答下列问题:
(1)用NaOH溶液处理废旧镀锌铁皮可以去除油污,还可以____________________。
(2)调节溶液A的pH可产生Zn(OH)2沉淀,为制得ZnO,后续操作步骤是_____→洗涤→_____。
(3)由溶液B制得Fe3O4胶体粒子的过程中,须持续通入N2,其原因是________________。
(4)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。请写出酸性条件下K2Cr2O7与Fe2+反应的离子方程式 (K2Cr2O7被还原为Cr3+)。
(5)若需配制浓度为0.01000 mol·L-1的K2Cr2O7标准溶液250mL,应准确称取K2Cr2O7 g(保留四位有效数字,已知M(K2Cr2O7)="294.0" g·mol-1)。配制该标准溶液时,下列仪器一定不要用到的有 (用编号表示)。
①电子天平 ②烧杯 ③量筒 ④玻璃棒 ⑤250 mL容量瓶 ⑥胶头滴管 ⑦托盘天平
(6)若配制K2Cr2O7标准溶液时,俯视刻度线,则测定结果_______(填“偏大”、“偏小”或“不变”,下同);滴定操作中,若滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则滴定结果将________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氧化锌粉末广泛应用于橡胶、涂料、陶瓷、化工、医药、玻璃等行业,为综合应用资源,常从冶炼锌、锌制品加工企业回收的锌渣(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质)来制取氧化锌,流程如图: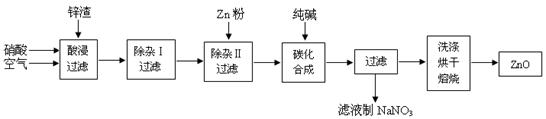
有关氢氧化物沉淀完全的pH见下表:
(1)在酸浸过程中,常将锌渣碎成粉末并通入空气,同时保持酸过量,理由是 。
(2)上述工艺多处涉及“过滤”,实验室中过滤需要使用的玻璃仪器有烧杯、 。
(3)①在“除杂Ⅰ”中,常用酸性KMnO4溶液,其目的是 ,KMnO4是该反应的 (氧化剂、还原剂)。将溶液的pH调至4,目的是 。
②在“除杂II”中,加入锌粉的目的是 。
(4)在“碳化合成”中,产物中有碱式碳酸锌[Zn2(OH)2CO3]和CO2等,请写出该反应的化学方程式 。
(5)本工艺中,过滤分离次数较多,其明显的缺陷是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
用18.4 mol·L-1的浓硫酸配制100 mL浓度为1 mol·L-1的稀硫酸,其操作可分为以下各步:
| A.用量筒量取5.4 mL浓硫酸,缓慢倒入装有约50 mL蒸馏水的烧杯里,并用玻璃棒搅拌 |
| B.用约30 mL蒸馏水,分成三次洗涤烧杯和玻璃棒,将洗涤液都倒入容量瓶中 |
| C.将稀释后的硫酸小心地倒入容量瓶中 |
| D.检查100 mL容量瓶口是否有漏液现象 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
.(16分)化学实验是科学探究的基础。请回答有关实验问题:
(1)下面的四个实验装置有三个都存在明显缺陷,其中完全正确的是 :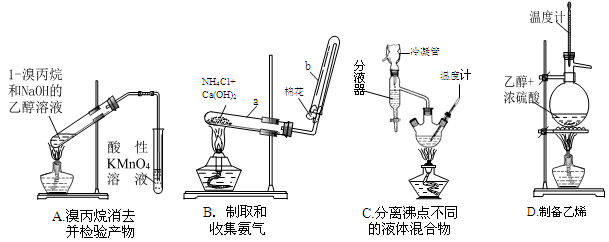
(2)要检验上面B装置氨气已集满的操作是 则试管已集满。
(3)ClO2是一种安全、高效、广谱、强力杀菌剂,其性质如右表:
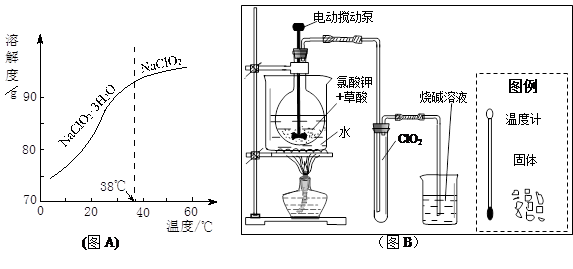
①由下表可以看出:保存液态ClO2的条件是密封、 ;ClO2与碱反应的离子方程式 ;观察下“图A”,要从NaClO2溶液制得不含结晶水的晶体,操作是蒸发结晶,控制条件是 ;应控制析出晶体的温度范围是 。
| 色态 | 溶于碱 | 超过1Kpa、受热或遇光 | |
| 常温气体 | -59-11℃ 红黄色液体 | 生成亚氯酸盐和氯酸盐 | 爆炸 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
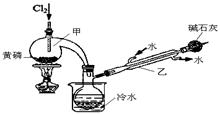
PCl3可用于半导体生产的外延、扩散工序。有关物质的部分性质如下:
| | 熔点/℃ | 沸点/℃ | 密度/g·mL-1 | 其他 |
| 黄磷 | 44.1 | 280.5 | 1.82 | 2P(过量)+3Cl2 2PCl3;2P+5Cl2(过量) 2PCl3;2P+5Cl2(过量) 2PCl5 2PCl5 |
| PCl3 | -112 | 75.5 | 1.574 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
| POCl3 | 2 | 105.3 | 1.675 | 遇水生成H3PO4和HCl,能溶于PCl3 |
 H3PO4+2HI;b.(NH4)3BO3溶液可与HI和H3PO4反应生成H3BO3(弱酸);c.Na2S2O3溶液可定量测定碘:I2+2Na2S2O3→Na2S4O6+2NaI
H3PO4+2HI;b.(NH4)3BO3溶液可与HI和H3PO4反应生成H3BO3(弱酸);c.Na2S2O3溶液可定量测定碘:I2+2Na2S2O3→Na2S4O6+2NaI查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com