
某原电池总反应离子方程式为:2Fe3++Fe=3Fe2+,不能实现该反应的原电池是( )
| A.正极为Cu,负极为Fe,电解质溶液为FeCl3溶液 |
| B.正极为C,负极为Fe,电解质溶液为Fe(NO3)3溶液 |
| C.正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3溶液 |
| D.正极为Ag,负极为Fe,电解质溶液为CuSO4溶液 |
 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:单选题
下列与金属腐蚀有关的说法正确的是
| A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重 |
| B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小 |
| C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大 |
| D.图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
试根据氧化还原反应:2FeCl3+Cu=2FeCl2+CuCl2设计原电池,并画出装置图。
指出电解质溶液是________________,负极是________________,电极反应式为__________________,正极是___________,电极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
两电极用导线连接插入电解质溶液中(不考虑溶液中溶解的氧气的影响),你认为不能构成原电池的是( )
| 选项 | A | B | C | D |
| 电极材料 | Zn | Fe | Cu | Al |
| 电极材料 | Cu | Zn | Ag | C |
| 电解质溶液 | CuCl2 溶液 | H2SO4溶液 | CuSO4 | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
如下图所示的两个实验装置,溶液的体积均为200mL。开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑盐的水解和溶液的体积变化,下列叙述中正确的是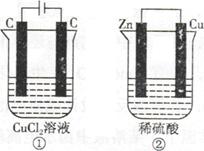
| A.产生气体的体积:①>② |
| B.溶液的pH变化:①减小,②增大 |
| C.电极上生成物质的质量:①=② |
| D.电极反应式:①中阳极2Cl—-2e—=Cl2↑,②中负极2H++2e—=H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
利用如图装置进行实验,甲乙两池均为1 mol·L-1的AgNO3溶液,A、B均为Ag电极。实验开始先闭合K1,断开K2。一段时间后,断开K1,闭合K2,形成浓差电池,电流计指针偏转(Ag+浓度越大氧化性越强)。下列说法不正确的是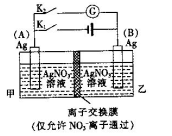
A.闭合K1,断开K2后,A电极增重
B.闭合K1,断开K2后,乙池溶液浓度上升
C.断开K1,闭合K2后,NO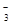 向B电极移动
向B电极移动
D.断开K1,闭合K2后,A电极发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
如图所示a、b 都是惰性电极,通电—段时间后,a极附近溶液显红色。下列说法中正确的是( )。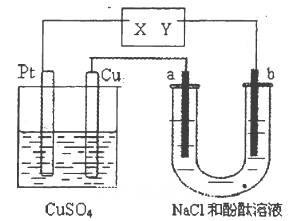
| A.X是正极,Y是负极 | B.X是负极,Y是正极 |
| C.CuSO4溶液的浓度逐渐减小 | D.CuSO4溶液的pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
甲烷燃料电池,分别选择H2SO4溶液和NaOH溶液做电解质溶液,下列有关说法正确的是( )
| A.总反应式都为CH4+2O2=CO2+2H2O |
| B.H2SO4和NaOH的物质的量都不变,但浓度都减小 |
| C.若用H2SO4溶液做电解质溶液,负极反应式为CH4-4e-+H2O=CO2+4H+ |
| D.若用NaOH溶液做电解质溶液,正极反应式为O2+2H2O+4e-=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故。根据电化学原理可进行如下处理:在铝质容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后发现黑色会褪去。下列说法正确的是( )
| A.处理过程中银器一直保持恒重 |
| B.银器为正极,Ag2S被还原生成单质银 |
| C.该过程中总反应为2Al+3Ag2S=6Ag+Al2S3 |
| D.黑色褪去的原因是黑色Ag2S转化为白色AgCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com