
【题目】秦皮是一种常用的中药,具有抗炎镇痛、抗肿瘤等作用。“秦皮素”是其含有的一种有效成分,结构简式如图所示,有关其性质叙述不正确的是( )

A.该有机物分子式为C10H8O5
B.分子中有四种官能团
C.该有机物能发生加成、氧化、取代等反应
D.1mol该化合物最多能与3molNaOH反应
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究铜跟浓硫酸的反应,用如图装置进行有关实验。请回答:
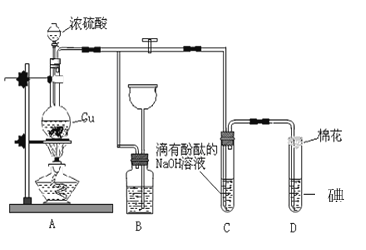
(1)装置A中发生的化学反应的化学方程式: _________________________________。
(2)装置B 的作用是__________________,B中广口瓶内应盛放的液体是_________(填序号)
①水 ②澄清石灰水
③Na2CO3溶液 ④饱和的NaHSO3 溶液
(3)装置C和D 中产生的现象相同,但原因却不同。C中反应的方程式:_______________________________________,而D 中则是由于SO2 具有_______性,D中反应的方程式:________________________。
(4)实验中,0.1molCu与含0.2mol硫酸的溶液反应后,铜和硫酸都有剩余。 可以证明有余酸的实验方案是___________
A.可再加入锌粒 B.可再加入氯化钡溶液
C.再加入银粉 D.再滴入碳酸氢钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锡为ⅣA族元素,四碘化锡是常用的有机合成试剂(SnI4,熔点114.5℃,沸点364.5℃,易水解)。实验室以过量锡箔为原料通过反应Sn+2I2![]() SnI4制备SnI4,装置如图(夹持、加热装置略去)。下列说法正确的是( )
SnI4制备SnI4,装置如图(夹持、加热装置略去)。下列说法正确的是( )
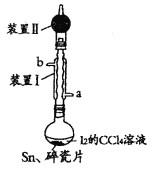
A.SnI4不溶于CCl4
B.装置Ⅰ中b为冷凝水进水口
C.加入碎瓷片的目的是防止暴沸
D.装置Ⅱ的主要作用是吸收挥发的I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O,M=392g·mol-1],俗称莫尔盐,是一种蓝绿色的无机复盐,易溶于水,在100℃~110℃时分解。
回答下列问题:
Ⅰ.探究莫尔盐强热时的分解产物
某同学认为莫尔盐分解的产物中可能含有SO3(g)、SO2(g)及N2(g)。为验证产物的存在,该同学用下列装置进行实验。
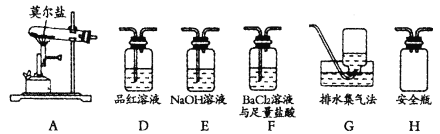
(1)该同学的实验中,装置依次连接的合理顺序为A→H→___→G。
(2)证明分解产物中含有SO3的实验现象是__。
Ⅱ.探究莫尔盐的纯度
某学生取mg莫尔盐样品配制成500mL溶液,根据物质组成,分别设计了如下实验方案。
方案甲:取20.00mL所配溶液于锥形瓶,用0.1000mol·L-1的酸性KMnO4溶液进行滴定。
方案乙:取20.00mL所配溶液进行如下实验。
![]()
(3)方案甲中盛装标准溶液的仪器名称为__;涉及反应的离子方程式为__;达到滴定终点的现象是___。
(4)方案乙测得样品的纯度为__%(用含m、w的式子表示)。
(5)若实验操作都正确,但方案甲的测定结果总是小于方案乙,其可能原因为__。设计实验,验证你的假设__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室研究潜水艇中供氧体系反应机理的装置图(夹持仪器略)。
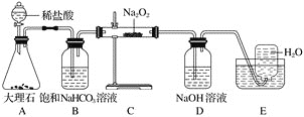
(1)A装置为CO2的发生装置,反应的离子方程式为____________________。
(2)B装置可除去A装置中可能挥发出的___________,反应的离子方程式为_______________。
(3)C装置为O2的发生装置,反应的化学方程式为__________________、________________。
(4)D装置可除去C装置中未反应的__________,反应的离子方程式为____________________。
(5)E装置为排水法收集O2的装置,检验所收集的气体为O2的方法为_____________________。
(6)C装置中固体由淡黄色完全变为白色,检验固体成分的实验方案为取少量C装置中反应后的固体溶于水,向溶液中滴入过量___溶液,若有白色沉淀生成,则证明固体中含有___;过滤,向滤液中滴入几滴酚酞溶液,若__且不褪色,则证明固体中含有__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质互为同分异构体的是( )
A. CH3—CH3和CH3—CH2—CH3
B. 12C和14C
C. CH3—CH2—CH2—CH3和(CH3)2CHCH3
D. 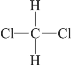 和
和 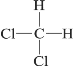
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在①CH2=CH2 ②![]() ③CH3CH2OH ④CH3COOH ⑤聚乙烯五种物质中:
③CH3CH2OH ④CH3COOH ⑤聚乙烯五种物质中:
(1)属于高分子化合物的是_____;(请填物质的序号,下同。);
(2)能使Br2的CCl4溶液褪色的是______;
(3)既能发生取代反应又能发生加成反应的是________;
(4)能与Na2CO3溶液反应的是_____;
(5)能发生酯化反应的是_______;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴(Co)是生产耐热合金、硬质合金、防腐合金、磁性合金和各种钴盐的重要原料,其金属性弱于 Fe 强于 Cu。某低位硫钴铜矿的成分为:CoS、CuFeS2、CaS、SiO2, 一种利用生物浸出并回收其中钴和铜的工艺流程如图:
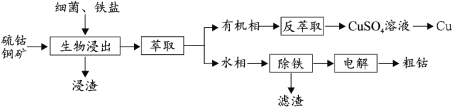
回答下列问题:
(1)Cu2+的生物浸出原理如下:
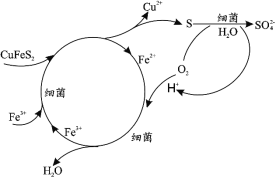
温度超过 50℃浸出率急剧下降,其原因是_____;其他金属离子的浸出原理与上图类似, 写出由 CoS 浸出 Co2+的离子方程式_____。
(2)浸出渣的主要成分为_____。
(3)萃取分离铜的原理如下:Cu2++2(HR)org![]() (CuR2)org+2H+。根据流程,反萃取加入的试剂应该为_____(写化学式)。
(CuR2)org+2H+。根据流程,反萃取加入的试剂应该为_____(写化学式)。
(4)除铁步骤中加入 H2O2,调节溶液的 pH 至 4,将 Fe2+转化为 FeOOH 过滤除去,写出该转化的离子方程式为_____。检验 Fe2+是否完全被转化的试剂为_____。
(5)通过电解法制得的粗钴含有少量铜和铁,需要电解精炼,进行精炼时,精钴应处于_____极(填“阴”或“阳”),阳极泥的主要成分为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A.在pH=7的溶液中:Fe3+、K+、Cl-、SO![]()
B.滴加KSCN溶液显红色的溶液中:NH![]() 、K+、Cl-、I-
、K+、Cl-、I-
C.c(OH-)/c(H+)=10-12的溶液中:NH![]() 、Cu2+、NO
、Cu2+、NO![]() 、SO
、SO![]()
D.水电离产生的c(OH-)=10-12 mol·L-1的溶液中:Na+、Al3+、Cl-、NO![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com