
下列叙述正确的是( )
A.在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原
B.元素由化合态变成游离态时,它可能被氧化,也可能被还原
C.元素的原子得失电子后,一定形成8电子的稳定结构
D.有单质参加或生成的反应一定属于氧化还原反应
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练4-1练习卷(解析版) 题型:选择题
下列说法中,正确的是( )
A.酸性氧化物都不与酸溶液反应
B.陶瓷、水泥及所有的玻璃都是硅酸盐产品
C.某些非金属单质既能与酸反应也能与碱反应
D.硅酸盐都是难溶于水的
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练3-2练习卷(解析版) 题型:选择题
用含少量镁粉的铝粉制取纯净的氢氧化铝,下述操作步骤中最恰当的组合是( )
①加盐酸溶解
②加烧碱溶液溶解
③过滤
④通入过量CO2生成Al(OH)3沉淀
⑤加入盐酸生成Al(OH)3沉淀
⑥加入过量烧碱溶液
A.①⑥⑤③ B.②③④③C.②③⑤③ D.①③⑤③
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练2-3练习卷(解析版) 题型:填空题
消毒剂在生产生活中有极其重要的作用,开发具有广普、高效、低毒的杀菌剂和消毒剂是今后发展的趋势。
(1)Cl2、H2O2、ClO2(还原产物为Cl-)、O3(1 mol O3转化为1 mol O2和1 mol H2O)等物质常被用作消毒剂。等物质的量的上述物质消毒效率最高的是________(填序号)。
A.Cl2 B.H2O2C.ClO2 D.O3
(2)H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称。如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O=A+NH3↑,则生成物A的化学式为________,H2O2被称为“绿色氧化剂”的理由是____________________________________
(3)漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年。亚氯酸不稳定可分解,反应的离子方程式为HClO2―→ClO2↑+H++Cl-+H2O(未配平)。在该反应中,当有1 mol ClO2生成时转移的电子个数约为________。
(4)“84”消毒液(主要成分是NaClO)和洁厕剂(主要成分是浓盐酸)不能混用,原因是__________________(用离子方程式表示)。利用氯碱工业的产物可以生产“84”消毒液,写出有关反应的化学方程式:____________。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练2-3练习卷(解析版) 题型:选择题
有下列三个反应:
①Cl2+FeI2=FeCl2+I2
②2Fe2++Br2=2Fe3++2Br-
③Co2O3+6HCl=2CoCl2+Cl2↑+3H2O
下列说法正确的是( )
A.反应①②③中的氧化产物分别是I2、Fe3+、CoCl2
B.根据以上方程式可以得到氧化性:Cl2>Fe3+>Co2O3
C.在反应③中当1 mol Co2O3参加反应时,2 mol HCl被氧化
D.可以推理得到Cl2+FeBr2=FeCl3+Br2
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练2-2练习卷(解析版) 题型:选择题
有一混合溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32—、SO42—,现取三份100 mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生;
(2)第二份加入足量NaOH溶液加热后,收集到气体0.06 mol;
(3)第三份加入足量BaCl2溶液后,所得沉淀经洗涤、干燥、称量为6.27 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g。根据上述实验,以下推测正确的是( )
A.K+一定存在
B.100 mL溶液中含0.01 mol CO32—
C.Cl-可能存在
D.Ba2+一定不存在,Mg2+可能存在
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练2-2练习卷(解析版) 题型:选择题
欲将混合液中Al3+、Cu2+、Ba2+、Ag+逐一沉淀出来加以分离,加入试剂①Cl- ②SO42—
③OH- ④CO2⑤CO32—的正确顺序是( )
A.①②③④ B.③⑤①②
C.②①③⑤ D.①⑤③②
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练1-3练习卷(解析版) 题型:填空题
已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
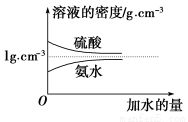
| 溶质的物质的量浓度/mol·L-1 | 溶液的密度/g·cm-3 |
硫酸 | c1 | ρ1 |
氨水 | c2 | ρ2 |
(1)表中硫酸的质量分数为________(不写单位,用含c1、ρ1的代数式表示)。
(2)物质的量浓度为c1 mol·L-1的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为________mol·L-1。
(3)物质的量浓度为c2 mol·L-1的氨水与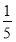 c2 mol·L-1的氨水等质量混合,所得溶液的密度________(填“大于”、“小于”或“等于”,下同)ρ2 g·cm-3,所得溶液的物质的量浓度________
c2 mol·L-1的氨水等质量混合,所得溶液的密度________(填“大于”、“小于”或“等于”,下同)ρ2 g·cm-3,所得溶液的物质的量浓度________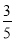 c2 mol·L-1(设混合后溶液的体积变化忽略不计)。
c2 mol·L-1(设混合后溶液的体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练1-1练习卷(解析版) 题型:选择题
下列由相关实验现象所推出的结论正确的是( )
A.Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性
B.向溶液中滴加酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定有SO42—
C.Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应
D.分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com