
【题目】某溶液中含有下列离子Na+ 、Fe3+.、Cl-、Fe2+.、NH4+向其中先加入足量的Na2O2,然后微热并搅拌,再加入足量的稀硫酸原溶液中离子数目基本不变的为( )
A.Na+B.Fe3+C.Cl-D.Fe2+
科目:高中化学 来源: 题型:
【题目】H2O2是实验室常见的强氧化剂,在医疗上可用作消毒剂等。
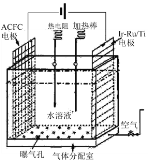
(1)一种正在开发的利用O2和H2O作原料通过化合制取H2O2的方法,其原理如图所示。该方法制取H2O2的总化学反应方程式为____。
(2)为探究外界条件对H2O2分解化学反应速率的影响,相关实验设计如下表所示:
试管 编号 | 实验目的 | H2O2溶液 | 温度 | 水的 体积/mL | FeCl3溶液体积/mL | |
质量 分数 | 体积/mL | |||||
Ⅰ | 为编号Ⅱ实验参照 | 12% | 5.0 | 常温 | 0 | 0 |
Ⅱ | 温度对反应速率的影响 | ( ) | 5.0 | 60℃ | 0 | 0 |
Ⅲ | 为编号Ⅳ实验参照 | 4.0% | 5.0 | 常温 | ( ) | 0 |
Ⅳ | ( ) | 4.0% | 5.0 | 常温 | 0 | 1.0 |
填写表中缺少的内容:Ⅱ_______;Ⅲ__________;Ⅳ_________。
(3)由铂(Pt位于左边)和金(Au位于右边)组成的纳米棒放入H2O2溶液中(如图),纳米棒将发生定向移动。
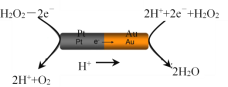
则:Au一侧为电池的____极(选填:“正”或“负”);纳米棒向____(选填:“左”或“右”)移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是![]()
![]()
A. ![]() 、
、![]() 、
、![]() 中,所有原子都满足最外层8电子的稳定结构
中,所有原子都满足最外层8电子的稳定结构
B. 在元素周期表中金属和非金属交界处可以找到半导体材料
C. 由非金属元素组成的化合物一定是共价化合物
D. 第ⅠA族元素和第ⅦA族元素的原子之间都能形成离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式,正确的是( )
A. 甲烷的燃烧热ΔH=-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B. 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
C. HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
D. 500 ℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】698K时,向VL的密闭容器中充入2molH2(g)和2molI2(g),发生反应:H2(g)+I2(g)![]() 2HI(g) ΔH=-26.5kJ·mol-1,测得各物质的物质的量浓度与时间变化的关系如图所示。
2HI(g) ΔH=-26.5kJ·mol-1,测得各物质的物质的量浓度与时间变化的关系如图所示。
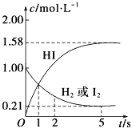
请回答下列问题:
(1)V=______。
(2)该反应达到最大限度的时间是_______,该时间内平均反应速率v(HI)=________。
(3)下列说法中可以说明反应2HI(g)![]() H2(g)+I2(g)已达到平衡状态的是_____。
H2(g)+I2(g)已达到平衡状态的是_____。
A.单位时间内生成nmolH2的同时生成2nmolHI
B.温度和体积一定时,容器内压强不再变化
C.条件一定,混合气体的平均相对分子质量不再变化
D.温度和压强一定时,混合气体的密度不再变化
(4)该反应达到平衡状态时,__________(填“吸收”或“放出”)的热量为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,参照元素![]() 在表中的位置,按要求回答下列问题:
在表中的位置,按要求回答下列问题:
周期主族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ⅧA |
一 |
| |||||||
二 |
|
|
| |||||
三 |
|
|
|
|
|
(1)在元素![]() ,最活泼的金属元素是______
,最活泼的金属元素是______![]() 填元素名称
填元素名称![]() ;最活泼的非金属元素名称是______
;最活泼的非金属元素名称是______![]() 填元素名称
填元素名称![]()
(2)用电子式表示元素![]() 与
与![]() 形成的原子个数比为1:2的化合物 _______________。元素①和③所形成的化学键的类型是___________________。
形成的原子个数比为1:2的化合物 _______________。元素①和③所形成的化学键的类型是___________________。
(3)![]() 、
、![]() 三种元素的原子半径由大到小的顺序是______
三种元素的原子半径由大到小的顺序是______![]() 用元素符号表示
用元素符号表示![]() 。
。
(4)元素![]() 和
和![]() 所能形成的气态氢化物的稳定性___________
所能形成的气态氢化物的稳定性___________![]() 化学式表示
化学式表示![]() ;元素
;元素![]() 、
、![]() 、
、![]() 的最高价氧化物对应的水化物的酸性由强到弱的顺序 ___
的最高价氧化物对应的水化物的酸性由强到弱的顺序 ___![]() 化学式表示
化学式表示![]()
(5)写出元素![]() 和
和![]() 的最高价氧化物的水化物相互反应的离子方程式:______________。
的最高价氧化物的水化物相互反应的离子方程式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)在溶液中会生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都是具有漂白作用。已知pOH=-lgc(OH-),经测定25℃时各组分含量随pOH变化情况如图所示(Cl-没有画出),此温度下,下列分析正确的是

A. HClO2的电离平衡常数的数值Ka=10-8
B. pOH=11时,ClO2-部分转化成ClO2和Cl-离子的方程式为:5ClO2-+2H2O=4ClO2+ Cl-+4OH-
C. pH=7时,溶液中含氯微粒的浓度大小为:c(HClO2)>c(ClO2-)>c(ClO2)>c(Cl-)
D. 同浓度的HClO2溶液和NaClO2溶液等体积混合,则混合溶液中有:c(Na+)+c(OH-)=c(H+)+ c(HClO2)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com