
【题目】亚氯酸钠(NaClO2)在溶液中会生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都是具有漂白作用。已知pOH=-lgc(OH-),经测定25℃时各组分含量随pOH变化情况如图所示(Cl-没有画出),此温度下,下列分析正确的是

A. HClO2的电离平衡常数的数值Ka=10-8
B. pOH=11时,ClO2-部分转化成ClO2和Cl-离子的方程式为:5ClO2-+2H2O=4ClO2+ Cl-+4OH-
C. pH=7时,溶液中含氯微粒的浓度大小为:c(HClO2)>c(ClO2-)>c(ClO2)>c(Cl-)
D. 同浓度的HClO2溶液和NaClO2溶液等体积混合,则混合溶液中有:c(Na+)+c(OH-)=c(H+)+ c(HClO2)
【答案】D
【解析】
A,HClO2的电离方程式为HClO2![]() H++ClO2-,电离平衡常数Ka=
H++ClO2-,电离平衡常数Ka=![]() ,由图像可见当c(HClO2)=c(ClO2-)时pOH=8,c(OH-)=1
,由图像可见当c(HClO2)=c(ClO2-)时pOH=8,c(OH-)=1![]() 10-8mol/L,c(H+)=1
10-8mol/L,c(H+)=1![]() 10-6mol/L,电离平衡常数Ka=1
10-6mol/L,电离平衡常数Ka=1![]() 10-6,A项错误;B,pOH=11时c(OH-)=1
10-6,A项错误;B,pOH=11时c(OH-)=1![]() 10-11mol/L,c(H+)=1
10-11mol/L,c(H+)=1![]() 10-3mol/L,溶液呈酸性,ClO2-部分转化成ClO2和Cl-的方程式为5ClO2-+4H+=4ClO2+Cl-+2H2O,B项错误;C,25℃pH=7时pOH=7,由图可见c(ClO2-)
10-3mol/L,溶液呈酸性,ClO2-部分转化成ClO2和Cl-的方程式为5ClO2-+4H+=4ClO2+Cl-+2H2O,B项错误;C,25℃pH=7时pOH=7,由图可见c(ClO2-)![]() c(HClO2)
c(HClO2)![]() c(ClO2),C项错误;D,同浓度的HClO2和NaClO2等体积的混合液中电荷守恒式为c(Na+)+c(H+)=c(ClO2-)+c(OH-),物料守恒式为2c(Na+)=c(HClO2)+c(ClO2-),两式整理得c(Na+)+c(OH-)=c(H+)+c(HClO2),D项正确;答案选D。
c(ClO2),C项错误;D,同浓度的HClO2和NaClO2等体积的混合液中电荷守恒式为c(Na+)+c(H+)=c(ClO2-)+c(OH-),物料守恒式为2c(Na+)=c(HClO2)+c(ClO2-),两式整理得c(Na+)+c(OH-)=c(H+)+c(HClO2),D项正确;答案选D。


 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案科目:高中化学 来源: 题型:
【题目】某溶液中含有下列离子Na+ 、Fe3+.、Cl-、Fe2+.、NH4+向其中先加入足量的Na2O2,然后微热并搅拌,再加入足量的稀硫酸原溶液中离子数目基本不变的为( )
A.Na+B.Fe3+C.Cl-D.Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】强酸与强碱的稀溶液发生中和反应的热效应为H+(aq)+OH(aq)![]() H2O(l) ΔH=57.3 kJ/mol。稀醋酸、浓硫酸、稀硝酸分别与0.1 mol·L1的NaOH溶液恰好完全反应,放出的热量与消耗NaOH溶液的体积之间的关系如图所示(CH3COOH电离要吸热)。则下列描述正确的是
H2O(l) ΔH=57.3 kJ/mol。稀醋酸、浓硫酸、稀硝酸分别与0.1 mol·L1的NaOH溶液恰好完全反应,放出的热量与消耗NaOH溶液的体积之间的关系如图所示(CH3COOH电离要吸热)。则下列描述正确的是

A.A表示稀硝酸与NaOH溶液的反应
B.B表示稀醋酸与NaOH溶液的反应
C.b=5.73
D.C表示浓硫酸与NaOH溶液的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2CO3溶液与盐酸反应过程中的能量变化示意图如图,下列反应属于吸热反应的是( )
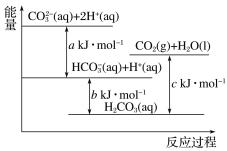
A. CO32-(aq)+H+(aq)=HCO3-(aq)
B. CO32-(aq)+2H+(aq)=CO2(g)+H2O(l)
C. HCO3-(aq)+H+(aq)=CO2(g)+H2O(l)
D. CO2(g)+H2O(l)=H2CO3(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“氢能”是未来最理想的新能源。
(1)实验测得,1 g氢气燃烧生成液态水时放出142.9 kJ热量,则氢气燃烧的热化学方程式为_____。(填序号)
A.2H2(g)+O2(g)=2H2O(l) ΔH =-142.9 kJ·mol1
B.H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ·mol1
C.2H2+O2=2H2O(l) ΔH= 571.6 kJ·mol1
D.H2(g)+1/2O2(g)=H2O(g) ΔH=-285.8 kJ·mol1
(2)某化学家根据“原子经济”的思想,设计了如下制备H2的反应步骤:
① CaBr2+H2O![]() CaO+2HBr
CaO+2HBr
② 2HBr+Hg![]() HgBr2+H2↑
HgBr2+H2↑
③ HgBr2+_______![]() ________
________
④ 2HgO![]() 2Hg+O2↑
2Hg+O2↑
⑤2H2+O2![]() 2H2O
2H2O
请你根据“原子经济”的思想完成上述步骤③的化学方程式:___________。并根据“绿色化学”的思想评估该方法制H2的主要缺点_________。
(3)利用核能把水分解制氢气,是目前正在研究的课题。如图是其中的一种流程,其中用了过量的碘。
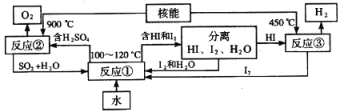
完成下列反应的化学方程式:反应①______________;反应②____________。此法制取氢气的最大优点是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
①H2(g)+1/2O2(g)=H2O(l) ΔH =-285.8 kJ/mol
②H2(g)+1/2O2(g)=H2O(g) ΔH =-241.8 kJ/mol
③C(s)+1/2O2(g)=CO(g) ΔH =-110.5 kJ/mol
④C(s)+O2(g)=CO2(g) ΔH =-393.5 kJ/mol
回答下列问题:
(1)H2的燃烧热ΔH=_______;C的燃烧热为__________。
(2)燃烧1 g H2生成液态水,放出的热量为_________。
(3)已知CO的燃烧热为283.0 kJ/mol,现有CO、H2和CO2组成的混合气体116.8 L(标准状况),完全燃烧后放出总热量为867.9 kJ,且生成18 g液态水,则混合气体中H2为_________L,CO在混合气体中的体积分数约为_________(精确至小数点后一位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在铝与稀硫酸的反应中,已知10s末硫酸的浓度减少了0.6 mol/L,不考虑反应过程中溶液体积的变化,则10s内生成硫酸铝的平均反应速率是( )
A. 0.02 mol/(Lmin)B. 1.2 mol/(Lmin)
C. 1.8mol/(Lmin)D. 0.18 mol/(Lmin)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子组在给定条件下能否大量共存的判断正确,所发生反应的离子方程式也正确的是
选项 | 条件 | 离子组 | 离子共存判断及反应离子方程式 |
A | 滴加氨水 | Na+、Al3+、Cl-、NO3- | 不能共存,Al3++3OH-=Al(OH)3↓ |
B | pH =1的溶液 | Fe2+、Al3+、SO42-、MnO4- | 不能共存,5Fe2++MnO4-+8H+= Mn2++5Fe3++4H2O |
C | 由水电离出的H+浓度为1×10-12 mol·L-1 | NH4+、Na+、NO3-、Cl- | 一定能共存,NH4++ H2O |
D | 通入少量SO2气体 | K+、Na+、ClO-、SO42- | 不能共存,2C1O- +SO2+H2O=2HC1O+SO32- |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示, 下列说法中不正确的是( )

A. 1mol该有机物和过量的金属钠反应最多可以生成1.5 molH2
B. 该有机物消耗Na、NaOH、NaHCO3的物质的量之比为3∶2∶2
C. 可以用酸性KMnO4溶液检验其中的碳碳双键
D. 该有机物能够在催化剂作用下发生酯化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com