
【题目】已知下列热化学方程式:
①H2(g)+1/2O2(g)=H2O(l) ΔH =-285.8 kJ/mol
②H2(g)+1/2O2(g)=H2O(g) ΔH =-241.8 kJ/mol
③C(s)+1/2O2(g)=CO(g) ΔH =-110.5 kJ/mol
④C(s)+O2(g)=CO2(g) ΔH =-393.5 kJ/mol
回答下列问题:
(1)H2的燃烧热ΔH=_______;C的燃烧热为__________。
(2)燃烧1 g H2生成液态水,放出的热量为_________。
(3)已知CO的燃烧热为283.0 kJ/mol,现有CO、H2和CO2组成的混合气体116.8 L(标准状况),完全燃烧后放出总热量为867.9 kJ,且生成18 g液态水,则混合气体中H2为_________L,CO在混合气体中的体积分数约为_________(精确至小数点后一位)。
【答案】285.8 kJ/mol 393.5 kJ/mol142.9 kJ22.439.4%
【解析】
(1)燃烧热是指1mol纯物质完全燃烧生成稳定的氧化物所放出的热量,水为液态水;
(2)根据热化学方程式计算;
(3)根据水的质量利用燃烧热计算氢气燃烧放出的热量,再根据一氧化碳放出的热量以及燃烧热计算一氧化碳体积,从而计算CO的体积分数。
(1)燃烧热指1mol可燃物完全燃烧生成稳定的化合物时所放出的热量,根据热化学方程式的含义,H2的标准燃烧热的热化学方程式为H2(g)+1/2O2(g)=H2O(l) ΔH =-285.8 kJ/mol,因此氢气的燃烧热ΔH=285.8 kJ/mol;根据C(s)+O2(g)=CO2(g) ΔH =-393.5 kJ/mol可判断碳的燃烧热为393.5 kJ/mol;
(2)1g氢气的物质的量是0.5mol,则燃烧1 g H2生成液态水,放出的热量为0.5mol×285.8 kJ/mol=142.9 kJ;
(3)n(H2O)=18g÷18g/mol=1mol,根据氢原子守恒得n(H2O)=n(H2)=1mol,则混合气体中H2为22.4L(标准状况下),根据H2(g)+1/2O2(g)=H2O(l) ΔH =-285.8 kJ/mol知,氢气完全燃烧放出的热量是285.8 kJ,则CO完全燃烧放出的热量=867.9 kJ-285.8 kJ=582.1 kJ。设CO的物质的量是x mol,已知CO的燃烧热为283.0 kJ/mol,所以283x=582.1,解得x=2.06,标况下体积是2.06mol×22.4L/mol=46.07L,因此CO在混合气体中的体积分数约为![]() 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)在溶液中会生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都是具有漂白作用。已知pOH=-lgc(OH-),经测定25℃时各组分含量随pOH变化情况如图所示(Cl-没有画出),此温度下,下列分析正确的是

A. HClO2的电离平衡常数的数值Ka=10-8
B. pOH=11时,ClO2-部分转化成ClO2和Cl-离子的方程式为:5ClO2-+2H2O=4ClO2+ Cl-+4OH-
C. pH=7时,溶液中含氯微粒的浓度大小为:c(HClO2)>c(ClO2-)>c(ClO2)>c(Cl-)
D. 同浓度的HClO2溶液和NaClO2溶液等体积混合,则混合溶液中有:c(Na+)+c(OH-)=c(H+)+ c(HClO2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、G五种主族元素分属三个短周期;且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。请用化学用语回答下列问题:
(1)G简单离子的结构示意图为____,Y、Z、M简单离子的半径由大到小的顺序为____(用离子符号表示)。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是___(填化学式);Y、M的简单氢化物沸点较高的是____(填化学式),组成该物质的分子的空间结构为_____。
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有______(写两种,填化学式)。
(4)Z、Y两种元素的单质在加热条件下可发生反应,产物的电子式为______。
(5)M的单质与其最高价氧化物对应水化物反应的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝氢化钠(NaAlH4)是有机合成的重要还原剂,其合成线路如下图所示。
![]()
(1)铝氢化钠遇水发生剧烈反应,其反应的化学方程式为_____________________。
(2)AlCl3与NaH反应时,需将AlCl3溶于有机溶剂,再将得到的溶液滴加到NaH粉末上,此反应中NaH的转化率较低的原因是__________________。
(3)实验室利用下图装置制取无水AlCl3。
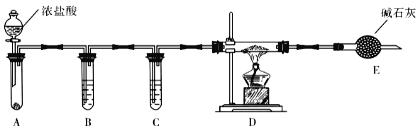
①A中所盛装的试剂是_______________。
②点燃D处酒精灯之前需排除装置中的空气,其操作是______________________。
(4)改变A和D中的试剂就可以用该装置制取NaH,若装置中残留有氧气,制得的NaH中可能含有的杂质为____________
(5)现设计如下四种装置,测定铝氢化钠粗产品(只含有NaH杂质)的纯度。

从简约性、准确性考虑,最适宜的装置是_________(填编号)。称取15.6g样品与水完全反应后,测得气体在标准状况下的体积为22.4L,样品中铝氢化钠的质量分数为___________。(结果保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
A. 温度一定时,Ksp(SrSO4)随c(SO42—)的增大而减小
B. 三个不同温度中,313 K时Ksp(SrSO4)最大
C. 283 K时,图中a点对应的溶液是饱和溶液
D. 283 K下的SrSO4饱和溶液升温到363 K后变为不饱和溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普通水泥在固化过程中其自由水分子减少并形成碱性溶液。根据这一物理化学特点,科学家发明了电动势法测水泥的初凝时间。此法的原理如图所示,反应的总方程式为2Cu+Ag2O=Cu2O+2Ag。下列有关说法正确的是( )

A. 测量原理示意图中,电流方向从Cu流向Ag2O
B. 负极的电极反应式为2Cu+2OH--2e-=Cu2O+H2O
C. 电池工作时,OH-向正极移动
D. 2molCu与1molAg2O的总能量低于1molCu2O与2molAg具有的总能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com